

| 某温度 |
| 某温度 |


科目:高中化学 来源: 题型:
 炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附.取一块制作炭雕的下脚料,进行下面的实验.下列有关叙述不正确的是( )
炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附.取一块制作炭雕的下脚料,进行下面的实验.下列有关叙述不正确的是( )| A、将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体 |
| B、将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色 |
| C、将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体 |
| D、将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键 |
| B、任何分子间在任意情况下都会产生范德华力 |
| C、范德华力与化学键的区别是作用力的强弱问题 |
| D、范德华力非常微弱,故破坏范德华力不需要消耗能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
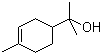 )的分子式为
)的分子式为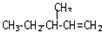 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.
A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.查看答案和解析>>
科目:高中化学 来源: 题型:
16 8 |
17 8 |
18 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com