
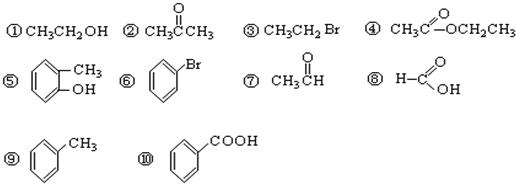
分析 (1)含C、H、卤素原子的有机物为卤代烃;
(2)含-COOC-的含氧衍生物为酯;
(3)含C、H、O元素,且含-OH与脂肪烃基相连的为醇;
(4)含C、H、O元素,且含-CHO的为醛;
(5)含C、H、O元素,且含-COOH的为羧酸.
解答 解:(1)含C、H、卤素原子的有机物为卤代烃,则③⑥为卤代烃,故答案为:③⑥;
(2)含-COOC-的含氧衍生物为酯,则只有④属于酯,故答案为:④;
(3)含C、H、O元素,且含-OH与脂肪烃基相连的为醇,则只有①属于醇,故答案为:①;
(4)含C、H、O元素,且含-CHO的为醛,则只有⑦属于醛,故答案为:⑦;
(5)含C、H、O元素,且含-COOH的为羧酸,则只有⑧⑩属于羧酸,故答案为:⑧⑩.
点评 本题考查有机物官能团与分类,为高频考点,把握有机物的组成、官能团及类别为解答的关键,侧重分析与应用能力的考查,注意有机物的分类,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X:它的原子中 M 层比L 层少 2 个电子 | |
| B. | 元素Y:它的焰色反应颜色呈紫色 | |
| C. | 元素Z:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:位于元素周期表中的第三周期,ⅢA 族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
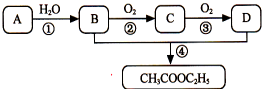 已知气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.A、B、C、D在一定条件下存在如下转化关系(反应条件、部分产物被省略).请回答下列问题:
已知气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.A、B、C、D在一定条件下存在如下转化关系(反应条件、部分产物被省略).请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
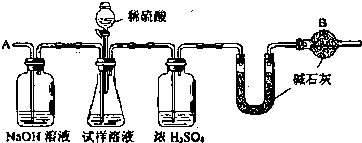
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
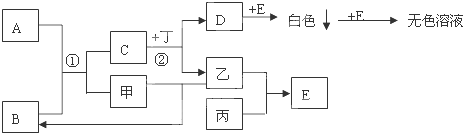
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何金属元素与非金属元素之间的化合 | |
| B. | 任意两种元素之间的化合 | |
| C. | 典型活泼金属和典型活泼非金属之间的化合 | |
| D. | 两种非金属元素之间的化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
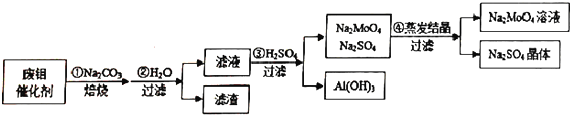
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com