
(1)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O Al(OH)4- +H+
②NH3+H2O
Al(OH)4- +H+
②NH3+H2O NH4++OH-
NH4++OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式
(B)已知N2H4是二元弱碱,试写出其二步电离方程式
。
(2)将a mol Cl2通入含 b mol FeBr2的溶液中,若0<a/b≤1/2时,反应的离子方程式为2Fe2+ +Cl2 = 2Fe3+ +2 Cl-,写出另2个可能发生的离子方程式。
①当 1/2< a/b<3/2时 。
②当a/b≥3/2时 。
(1)A、 B(OH)3+H2O B(OH)4-+H+
B(OH)4-+H+
B、N2H4+H2O
 N2H5+ +OH- N2H5+ + H2O
N2H5+ +OH- N2H5+ + H2O N2H62+ +OH-
N2H62+ +OH-
(2)①b Fe2++(2a-b)Br-+aCl2 = b Fe3++(a-b/2)Br2+2 aCl-
②2 Fe2++4Br-+3Cl2 = 2Fe3+ +2Br2+6Cl-
【解析】(1)A、B(OH)3是一元弱酸,所以根据①可知,电离方程式为B(OH)3+H2O B(OH)4-+H+。
B(OH)4-+H+。
B、N2H4是二元弱碱,则根据②可知,电离方程式为N2H4+H2O
 N2H5+ +OH-、N2H5+
+ H2O
N2H5+ +OH-、N2H5+
+ H2O N2H62+ +OH-。
N2H62+ +OH-。
(2)由于亚铁离子的还原性强于溴离子的,所以氯气首先氧化亚铁离子。氧化亚铁离子需要b/2mol,全部氧化溴化亚铁需要3b/2mol,所以当1/2< a/b<3/2时,亚停止了全部被氧化,溴离子部分被氧化,方程式为b Fe2++(2a-b)Br-+aCl2 = b Fe3++(a-b/2)Br2+2 aCl-;当a/b≥3/2时,溴化亚铁全部被氧化,方程式为2 Fe2++4Br-+3Cl2 = 2Fe3+ +2Br2+6Cl- 。


科目:高中化学 来源: 题型:
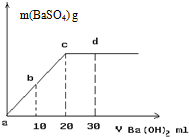 (1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
(1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省汉中市中学高三上学期模拟考试化学试卷(带解析) 题型:填空题
(1)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O Al(OH)4- +H+ ②NH3+H2O
Al(OH)4- +H+ ②NH3+H2O NH4++OH-
NH4++OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式
(B)已知N2H4是二元弱碱,试写出其二步电离方程式
。
(2)将a mol Cl2通入含 b mol FeBr2的溶液中,若0<a/b≤1/2时,反应的离子方程式为2Fe2+ +Cl2 = 2Fe3+ +2 Cl-,写出另2个可能发生的离子方程式。
①当1/2< a/b<3/2时 。
②当a/b≥3/2时 。
查看答案和解析>>
科目:高中化学 来源:湖北省八市2010年高三第一次联合联考理综化学 题型:实验题
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O 。该电池工作时,正极发生的电极反应式为: 。此时,正极周围海水的pH: (填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
① Al(OH)3 +H2O Al(OH)4-+ H+
②NH3+H2O
Al(OH)4-+ H+
②NH3+H2O NH4+
+ OH-
NH4+
+ OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式 。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广西省高三上学期第三次月考化学试卷 题型:填空题
(12分)⑴某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是____;若反应过程中转移了0.3moL电子,则氧化产物的质量是__ g。
⑵将a mol Cl2 通入含b mol FeBr2的溶液中,
当0< a / b≤1/2 时,反应的离子方程式为: 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,
写出另2个可能发生的离子方程式:
① 当 a / b =1时,_______________________ ______;
② 当a / b≥3/2时,________________ _____________。
⑶观察如下反应,总结规律,然后完成下列问题:
①
Al(OH)3 +H2O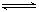 Al(OH)4- + H+
②NH3+H2O
Al(OH)4- + H+
②NH3+H2O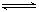 NH4+
+ OH_
NH4+
+ OH_
Ⅰ.已知B(OH)3是一元弱酸,试写出其电离方程式________________________ __
Ⅱ.N2H4是二元弱碱,试写出其第二步电离方程式___________ _________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com