
| A、盐酸滴定氨水,可以选择酚酞为指示剂 |
| B、电离程度(同温度同浓度溶液中):HCl>CH3OOH>NaHCO3 |
| C、分散质粒子的直径:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3悬浊液 |
| D、若要使Na2S溶液中c(Na+)/c(S2-)的值减小,可以加入适量的KOH固体 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、钠在氧气中燃烧,钠的氧化产物: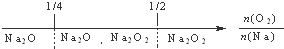 |
B、铁在Cl2中燃烧,铁的氧化产物: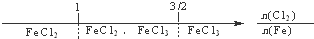 |
C、NH3与Cl2反应,反应产物: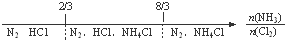 |
D、FeBr2溶液中通入Cl2,铁元素存在形式: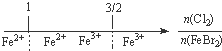 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、SO42-、CH3COO-、Cl- |
| B、K+、Na+、NO3-、Ba2+ |
| C、SO42-、Ba2+、Cl-、AlO2- |
| D、Mg2+、Na+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、70℃,将0.1 mol 镁粉加入到10 mL 6 mol?L-1 的硝酸溶液中 |
| B、60℃,将0.2 mol 镁粉加入到20 mL 3 mol?L-1 的盐酸溶液中 |
| C、60℃,将0.1 mol 镁粉加入到10 mL 3 mol?L-1 的硫酸溶液中 |
| D、60℃,将0.2 mol 铁粉加入到10 mL 3 mol?L-1 的盐酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br2+2I-=I2+2 Br- |
| B、2FeCl2+Cl2=2FeCl3 |
| C、2FeCl2+2HCl+I2=2FeCl3+2HI |
| D、2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com