
| m |
| n |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(HCO3-)=0.1mol/L的溶液中:Na+、AlO2-、Cl-、NO3- |
| B、在既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、NH4+、K+、NO3- |
| C、在水电离出的c(H+)=1×10-14mol/L的溶液中:Na+、SO42-、ClO-、Cl- |
| D、在pH=13的溶液中:SO32-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①②⑤ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃101kPa时,CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol |
| B、CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的△H<0 |
| C、反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零): H2(g)+Cl2(g)=2HCl(g)△H1=-Q1 kJ/mol H2(g)+Br2(g)=2HBr(g)△H2=-Q2 kJ/mol 则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
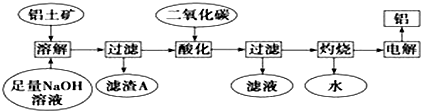
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com