
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol| 50Q2 |
| Q1 |
| 50Q2 |
| Q1 |
| 1 |
| 9 |
| 1 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1.01×105 Pa,273℃时气态单质Xn的密度为d g/L,则X的相对原子质量为_________________。
(2)相同状况下,一定体积的X的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为_______________________________。
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为____________________。
(4)标准状况下,1体积水可以溶解700体积氨气,所得溶液的密度为0.90 g·cm-3,则所得氨水的物质的量浓度为__________________。
(5)已知98%的浓H2SO4溶液的物质的量浓度为18.4 mol/L,试判断49%的H2SO4溶液的物质的量浓度______(“大于”“小于”或“等于”)9.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2011届广东省六校高三上学期第二次联考(理综)化学部分 题型:实验题
(16分)磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。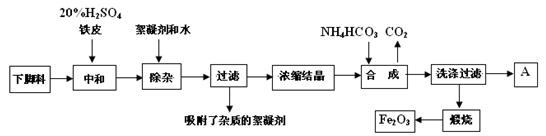

已知煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
| A.玻璃棒 | B.烧杯 | C.漏斗 | D.250mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省六校高三上学期第二次联考(理综)化学部分 题型:实验题
(16分)磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。

已知煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
A、玻璃棒 B、烧杯 C、漏斗 D、250mL容量瓶
E、500mL容量瓶 F、胶头滴管
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;
此溶液中各离子的浓度比较大小为: 。
(3)20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示):
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com