
| A. | ae | B. | aef | C. | abc | D. | ac |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:a.各物质的浓度不变,说明正逆反应速率相等,反应达平衡状态,故正确;
b.反应①两边的计量数相等,容器内气体压强始终不变,故错误;
c.反应①容器内气体密度始终不变,故错误;
d.反应②容器内气体颜色始终不变,故错误;
e.各组分的物质的量分数或质量分数不变,说明各物质的量不变,正逆反应速率相等,达平衡状态,故正确;
f.反应①两边的计量数相等,混合气体的平均相对分子质量始终不变,故错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
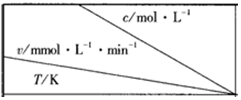 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| C. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW/C(OH-)=10-12mol•L-1的溶液中:Na+、K+、SiO32-、Cl- | |
| B. | 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| C. | 由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液中:Na+、CO32-、SO32-、Cl- | |
| D. | 使KSCN显红色的溶液中:NH4+、K+、Cl-、A1O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
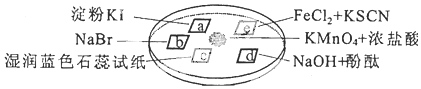
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
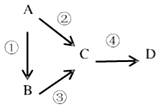 A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、Cl-、CO32- | B. | Fe3+、Mg2+、NO3-、SCN- | ||
| C. | NO3- H+、Fe2+、SO42- | D. | Na+、OH-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com