
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)====CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)====CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)====2CO2(g) ΔH3<0
2H2(g)+O2(g)====2H2O(g) ΔH4<0
请回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量______途径Ⅱ放出的热量(填“大于”“等于”或“小于”)。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是________________________。
(3)由于制取水煤气的反应里,反应物具有的总能量_______(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为_________________。
(4)已知:Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ·mol-1②
Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_______________________________。
【解析】(1)由盖斯定律可知,反应焓变只与始态和终态有关,而与反应的途径无关。通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量。
(2)由盖斯定律,将途径Ⅱ的三个化学方程式分别调整系数后叠加可得:ΔH1=ΔH2+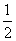 (ΔH3+ΔH4)。
(ΔH3+ΔH4)。
(3)因为C(s)+H2O(g)====CO(g)+H2(g) ΔH>0,所以在制取水煤气的反应中,反应物具有的总能量小于生成物具有的总能量,在发生反应时,反应物需要吸收能量转化为生成物,因此其反应条件为高温。
(4)由盖斯定律可得ΔH= =
=
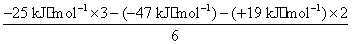
=-11 kJ·mol-1。
答案:(1)等于
(2)ΔH1=ΔH2+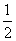 (ΔH3+ΔH4)
(ΔH3+ΔH4)
(3)小于 吸收 高温
(4)FeO(s)+CO(g)====Fe(s)+CO2(g) ΔH=-11 kJ·mol-1


科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 金属汞洒落,必须尽可能收集起来,并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞 |
|
| B. | 滴定管在使用前要用待装液润洗,而容量瓶不用润洗 |
|
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
|
| D. | 碘单质与食盐的分离常用升华法,而碘水中提取碘单质则常用萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,正确的是
A. 苯和乙烯都可以使溴的四氯化碳溶液褪色
B. 等物质的量的乙烯和乙醇完全燃烧消耗氧气的量不相等
C. 乙醇的酯化反应和酯的水解反应均属于取代反应
D. 聚乙烯可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①在热化学方程式中无论是反应物还是生成物都必须标明状态
②所有的化学反应都伴随着能量变化
③放热反应发生时不必加热
④吸热反应在加热后才能发生
⑤化学反应的热效应数值只与参加反应的物质的多少有关
⑥一般来说,吸热反应在一定条件下也能发生
A.②③⑥ B.③④⑤
C.④⑤ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-Q kJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1 mol SO3固体放热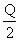 kJ
kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为常温下用0.10mol·L-1NaOH溶液滴定20.00 mL 0.10 mol·L-1盐酸和20.00 mL 0.10 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
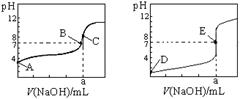
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH)>V(HA)
D.当0mL<V(NaOH)<20. 00mL时,溶液中一定是c(A-)>c(Na+)>c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.元素的原子序数越大,其族序数也越大
B.同周期的第ⅡA族与第ⅢA族的原子序数一定相差1
C.在元素周期表中,第14列元素所形成的化合物种类最多
D.元素的最外层电子数为奇数,其族序数不一定为奇数
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组设计以下实验,探究化学反应
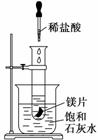
中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。试回答下列问题:
实验中观察到的现象是________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式:___________________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是______________________________________________________
________________________________________________________________________
______________________,其原因是____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是( )
A.“四中子”不显电性
B.“四中子”的质量数为4,其质量比氢原子大
C.“零号元素”在元素周期表中与氢元素占同一位置
D.第二种粒子的化学式为O4,与O2互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com