
| A.煤经过气化和液化两个物理变化,可变为清洁能源 |
| B.古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C.明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视 |
| D.单晶硅太阳能电池板可以将太阳能直接转变为电能 |
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:不详 题型:填空题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用盐的形式表示:BaSiO3·CuSiO3 |
| B.用氧化物形式表示:BaO·CuO·2SiO2 |
| C.易溶于强酸、强碱 |
| D.性质稳定,不易褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
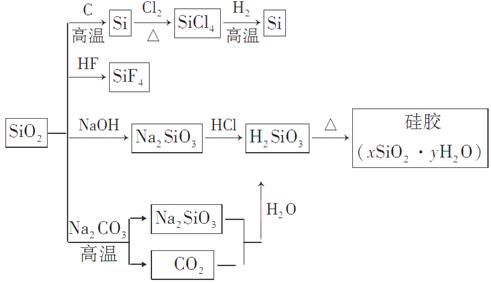
| A.SiO2属于两性氧化物 |
| B.盛放Na2CO3溶液的试剂瓶不能用玻璃塞 |
| C.硅胶吸水后不能重复再生 |
| D.图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 溶液 | 操作及现象 |
| A | CaCl2溶液 | 通入CO2,溶液不变浑浊;再通入氨气,溶液变浑浊 |
| B | Na2SiO3溶液 | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失 |
| C | Ca(ClO)2溶液 | 通入CO2,溶液变浑浊;再加入品红溶液,红色不褪去 |
| D | BaCl2溶液 | 先通入NO2,再通入SO2至过量,先生成沉淀后沉淀消失 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.能耗大是该方法的一大缺点 |
| B.整个过程中,可以循环利用的物质是CaO和NaOH |
| C.“反应、分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
| D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1442Si原子核内含有42个中子 | B.硅用于制造光导纤维 |
| C.二氧化硅用于半导体材料 | D.SiO2可以与弱酸HF反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.利用Si和O在周期表中的位置 |
| B.SiO2与水不发生反应 |
| C.Si在一定条件下与氧气反应,生成SiO2 |
| D.H2SiO3的酸性比H2O的酸性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
 CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com