
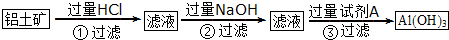

分析 铝土矿主要成分是Al2O3,含SiO2、Fe2O3等杂质,向铝土矿中加入分离HCl,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和稀盐酸不反应,滤液中含有HCl、AlCl3、FeCl3,向滤液中加入过量NaOH溶液,发生反应HCl+NaOH=NaCl+H2O、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl,所以沉淀是Fe(OH)3,滤液中含有NaCl、NaAlO2,向滤液中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,得到沉淀Al(OH)3;
向铝土矿中加入过量NaOH溶液,二氧化硅和氧化铝都与NaOH溶液反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,所以滤液中成分是NaAlO2、Na2SiO3,Fe2O3NaOH溶液不反应,向滤液中通入过量盐酸,生成氯化铝和硅酸,过滤得到氯化铝溶液,再滤液中加入氨水,可得到沉淀Al(OH)3,以此解答该题.
解答 解:铝土矿主要成分是Al2O3,含SiO2、Fe2O3等杂质,向铝土矿中加入分离HCl,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和稀盐酸不反应,滤液中含有HCl、AlCl3、FeCl3,向滤液中加入过量NaOH溶液,发生反应HCl+NaOH=NaCl+H2O、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl,所以沉淀是Fe(OH)3,滤液中含有NaCl、NaAlO2,向滤液中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,得到沉淀Al(OH)3;
向铝土矿中加入过量NaOH溶液,二氧化硅和氧化铝都与NaOH溶液反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,所以滤液中成分是NaAlO2、Na2SiO3,Fe2O3NaOH溶液不反应,向滤液中通入过量盐酸,生成氯化铝和硅酸,过滤得到氯化铝溶液,再滤液中加入氨水,可得到沉淀Al(OH)3,
(1)由以上分析可知方案2中,向铝土矿中加入过量氢氧化钠溶液,发生反应的离子方程式SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:SiO2+2OH-=SiO32-+H2O; Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(2)由以上分析可知试剂A为CO2,试剂B为NH3•H2O或NH3,过滤③分离的是偏铝酸钠与过量二氧化碳反应的产物,所得固体为Al(OH)3,所得滤液中溶质的主要成分是NaHCO3,
故答案为:CO2; NH3•H2O或NH3;NaHCO3;
(3)①已知0.1molAl与足量的Fe2O3粉末完全反应(产物都为固态),放出41.42kJ的能量,则2molAl参加反应放出828.4kJ热量,该反应的热化学方程式为2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-828.4 kJ•mol-1,
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-828.4 kJ•mol-1;
②铝热反应是利用了铝的还原性,铝置换出活泼性较铝弱的金属,铝不能置换出镁,故答案为:a.
点评 本题考查混合物的分离和提纯,为高考常见题型,侧重考查学生分析问题能力、实验操作能力,能从整体上把握元素化合物知识,知道流程图中各个过程发生的反应,会正确书写相应的化学方程式及离子方程式,题目难度中等.


科目:高中化学 来源: 题型:多选题
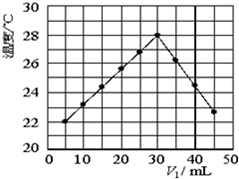 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )| A. | 做该实验时环境温度可能为20℃ | B. | 该实验表明化学能可以转化为热能 | ||
| C. | NaOH溶液的浓度约是1.5mol•L-1 | D. | 该实验表明中和反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HO3(浓)=3Cu(NO3)2+2NO↑+4H2O | ||
| C. |  | D. | 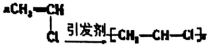 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(CH3COO-)+c(CH3COOH) | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ⑨淀粉和纤维素
⑨淀粉和纤维素查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com