
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式___。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=___。
(3)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为:___;
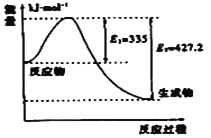
②若起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=___kJ·mol-1。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1 432kJ/mol 46.1kJ 18.44 6(c-b)-2a
O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1 432kJ/mol 46.1kJ 18.44 6(c-b)-2a
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)反应热=反应物总键能-生成物总键能,据此计算;
(3)①先求出此反应的焓变,根据计算出每生成1molNH3放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1;
(4)根据盖斯定律求解。
:(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热352KJ×(32/16)=704KJ, 故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1;
O2(g)=CO2(g)+2H2O(l)△H=﹣704kJmol﹣1;
(2)反应热=反应物总键能-生成物总键能,所以436kJ/mol+243kJ/mol-2E(H-Cl)=-185kJ/mol,解得E(H-Cl)=432KJ/mol,故答案为:432kJ/mol;
(3)①该反应的焓变△H=E1-E2=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以每生成1molNH3放出热量为46.1kJ。故答案为:46.1kJ;
②反应方程式为![]() ,由①知生成1molNH3放出热量为46.1kJ。起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,反应的N2物质的量为1mol×20%=0.2mol,根据方程式可知生成的氨气为0.4mol,故放出的热量为46.1kJ×(0.4mol/1mol)= 18.44KJ,故答案为:18.44;
,由①知生成1molNH3放出热量为46.1kJ。起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,反应的N2物质的量为1mol×20%=0.2mol,根据方程式可知生成的氨气为0.4mol,故放出的热量为46.1kJ×(0.4mol/1mol)= 18.44KJ,故答案为:18.44;
(4)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJmol-1
②CO(g)+1/2O2(g)=CO2(g)△H=bkJmol-1
③C(石墨)+O2(g)=CO2(g)△H=ckJmol-1
依据盖斯定律(③-②)×6-①×2得到4Fe(s)+3O2(g)=2Fe2O3(s)△H=6(c-b)-2a kJmol-1,故答案为:6(c-b)-2a;


科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述错误的是
A.分子中N—Cl键键长与CCl4分子中C—Cl键键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“![]() ”表示)结合形成NH3H2O分子,则NH3H2O的结构式为
”表示)结合形成NH3H2O分子,则NH3H2O的结构式为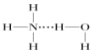
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、N、P、Q四块金属片,进行如下实验:
① M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极
中,Q是电子流入的一极
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡
,P极产生大量气泡
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应
中,Q极发生氧化反应
则四种金属的活动性顺序为
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】融雪剂通过降低冰雪融化温度的原理融化道路上的积雪。研究发现,一般融雪剂残留物可腐蚀路面和汽车轮胎等。目前我国北方在冬季仍采用沙土和铲雪车为主,融雪剂为辅的方式清除路面冰雪,保证道路通畅。
请回答下列问题:
(1)氯化钙是常用融雪剂的主要成分之一,以工业碳酸钙(含有少量Na+、Mg2+、Fe3+等杂质)生产氯化钙的主要流程如下:

①流程中试剂W的名称是 ________________。
②流程中滤渣的主要成分是________________(填化学式)。
③流程中操作Y的目的是_______________。
④如果用惰性电极电解用试剂W溶解后的溶液,则电解开始时阴极发生的电极反应式为_________。
(2)下列就融雪剂使用的有关原理的解释正确的是_________________。
A.“会加快冰雪的融化”是因为提高了冰点
B.“会造成绿化植物死亡”是与盐析有关
C.“会造成土壤板结贫瘠”是与物质的分解吸热有关
D.“会加快路基上铁的腐蚀”是与形成原电池有关
(3)某公司生产的融雪剂由NaCl、NaNO3、AlCl3、CuSO4、K2CO3中的几种物质组成。某同学设计下列过程探究其组成:
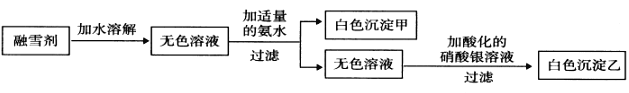
请回答下列问题:
①该融雪剂中一定不含的物质是_________________(填名称)。
②若取融雪剂样品a g,通过上述探究途径得白色沉淀乙bmol,则该融雪剂中含氯元素的质量分数为 ____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________,若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中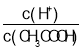 增大
增大
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中所得溶液中c(Cl-)=c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO
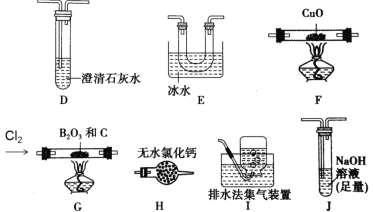
(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com