
��֪��������Ԫ�������ڱ��е����λ�����±���ʾ��
a | |||||
b | |||||
c | d | e |
�� ��1������Ԫ�������Ӱ뾶������ ������������������Ԫ�ط��ţ���
|
������ ������D��ε���A����Һ������������Ӧ�����е�
���ӷ���ʽ����Ϊ�������������������������������������������� �������� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


 HO2-+H+
HO2-+H+ HO2-+H+
HO2-+H+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
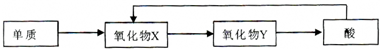


| ||
| �� |
| ||
| �� |
| T/K | 303 | 313 | 323 |
| CA2������/��10-1mol�� | 4.3 | 5.9 | 6.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ||
| ||
 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶�� С��BԪ�ص�����������Ӧˮ���������⻯���������Σ�D��Aͬ���壬����Eͬ�� �ڣ�EԪ��ԭ�ӵ��������������������������
A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶�� С��BԪ�ص�����������Ӧˮ���������⻯���������Σ�D��Aͬ���壬����Eͬ�� �ڣ�EԪ��ԭ�ӵ��������������������������| 3 | 4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com