
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | ||||
B、电解饱和食盐水的离子方程式:2Cl-+2H2O
| ||||
| C、加入铝粉能产生氢气的溶液中,可能存在大量的:K+、Ba2+、AlO2-、Cl- | ||||
| D、向淀粉KI溶液中滴加稀硫酸,溶液变蓝:4I-+O2+4H+=2H2O+2I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图所示的物质转化关系中,A是海水中含量 最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种白色凝胶状沉淀.(部分生成物和反应条件为列出)
在如图所示的物质转化关系中,A是海水中含量 最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种白色凝胶状沉淀.(部分生成物和反应条件为列出)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用0.2000 mol?L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol?L-1 ),至中性时,溶液中的酸未被完全中和 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| D、相同温度下,将足量氯化银固体分别放入相同体积的 ①蒸馏水; ②0.1 mol?L-1 盐酸; ③0.1 mol?L-1 氯化镁溶液; ④0.1 mol?L-1 硝酸银溶液中;Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
| ||
| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
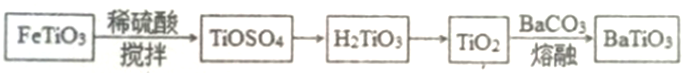
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸中碳原子都采用的是sp3杂化 |
| B、O2、CO2、N2都是非极性分子 |
| C、酸性:H2CO3<H3PO4<H2SO4<HClO |
| D、基态Fe原子的电子排布式为:1s22s22P63s23P64s23d6 |
| E、水分子间可以形成氢键,所以水分子很稳定. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同素异形体:C60、14C、金刚石 |
| B、酸性氧化物:SO2、NO、SiO2 |
| C、混合物:铝热剂、水玻璃、液氯 |
| D、电解质:明矾、冰醋酸、硫酸钡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com