
分析 (1)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,阳极上氧气得电子和水反应生成氢氧根离子;氢氧燃料酸性电池中,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水,据此书写电极反应式;
(2)碱性条件下,甲烷在负极失电子生成碳酸根离子和水.
解答 解:(1)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,阳极上氧气得电子和水反应生成氢氧根离子,碱性条件下,负极反应式为H2-2e-+2OH-═2H2O;氢氧燃料酸性电池中,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水,正极反应式为O2+4e-+4H+═2H2O,
故答案为:H2;H2-2e-+2OH-═2H2O;O2+4e-+4H+═2H2O;
(2)碱性条件下,甲烷在负极失电子生成碳酸根离子和水,则负极电极反应式为:CH4+10OH--8e-═CO32-+7H2O;
故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查了燃料电池,注意把握燃料电池中电极的判断和电极反应式的书写,电极反应式的书写要结合电解质溶液酸碱性,题目难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 平衡常数 | B. | SO3(g)的转化率 | C. | 总压强 | D. | 总体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
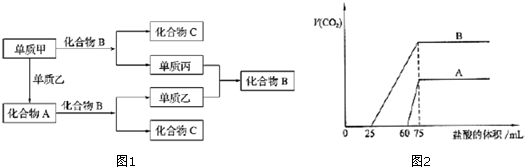
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
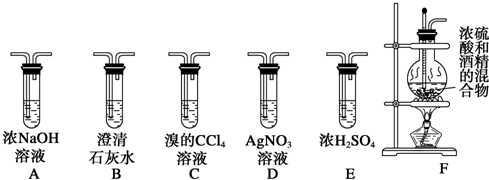
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
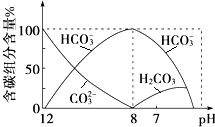 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
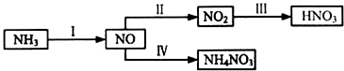
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
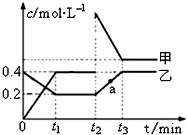
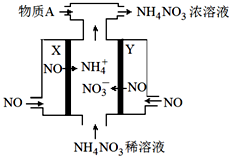
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
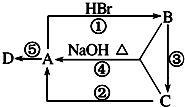 如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | B. | BaCl2+Na2SO4═BaSO4↓2NaCl | ||
| C. | BaCl2+H2SO4═BaSO4↓+2HCl | D. | BaCO3+H2SO4═BaSO4↓+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com