
| A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002 mol/L AgNO3 溶液,则CrO42-完全沉淀 |
| D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀 |
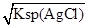 =1.56×10-10mol/L,饱和Ag2CrO4溶液中c(Ag+)=
=1.56×10-10mol/L,饱和Ag2CrO4溶液中c(Ag+)=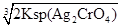 ,显然后者的c(Ag+)大,A错误;AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,B错误;两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=
,显然后者的c(Ag+)大,A错误;AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,B错误;两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=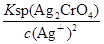 =
=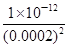 =2.5×10-5mol/L<1.0×10-5mol/L,故c(CrO42-)不能完全沉淀,C错误;根据Ksp (AgCl)、Ksp (Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=
=2.5×10-5mol/L<1.0×10-5mol/L,故c(CrO42-)不能完全沉淀,C错误;根据Ksp (AgCl)、Ksp (Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=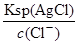 =1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=
=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=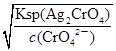 =4.36×10-5 mol/L,故先产生AgCl沉淀,D正确。答案选D。
=4.36×10-5 mol/L,故先产生AgCl沉淀,D正确。答案选D。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.25℃时,0.1 mol·L-1 HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 | D.该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuSO4·xH2O,当向硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是
CuSO4·xH2O,当向硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是| A.溶液中Cu2+浓度增大 | B.溶液中Cu2+数目减少 |
| C.该硫酸铜晶体体积增大 | D.溶液的蓝色变浅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的变化如下图所示。下列判断正确的是( )
的变化如下图所示。下列判断正确的是( ) 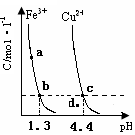
A.加适量浓NH3·H2O可使溶液由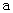 点变到 点变到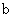 点 点 |
B.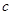  两点代表的溶液中 两点代表的溶液中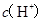 与 与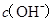 乘积不相等 乘积不相等 |
C.Cu(OH)2在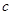 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的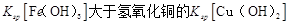 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀释前,溶液 pH:①>② = ③ |
| B.稀释前,溶液中溶质的物质的量浓度:③>① =② |
| C.稀释后,溶液 pH:①>② = ③ |
| D.稀释后,溶液中溶质的物质的量浓度:③>① =② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全。 |
| 实验现象 | 产生白色沉淀 |
| 离子方程式 | (1) |
| 小组讨论交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 | 假设Ⅰ: 无现象; 理由:反应没有限度,Ca2+沉淀完全 假设Ⅱ:(2) ,理由:(3) |
| 证明你的假设 | 现象:产生大量的白色沉淀 |
| 离子方程式 | (4) |
| 实验结论 | (5) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com