
�Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʣ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ڽ���Һ��ͼ��ʾ������в�����
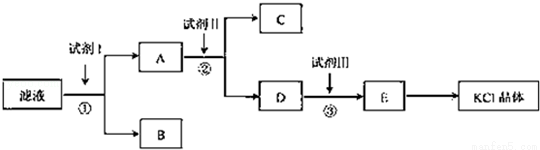
�ش��������⣺
��1����ʼ��Һ��pH�� ��7������ڡ�����С�ڡ����ڡ�������ԭ������ ����
��2���Լ�I�Ļ�ѧʽΪ�� �������з�����Ӧ�����ӷ���ʽΪ�� ����
��3���Լ����Ļ�ѧʽΪ�� �������м����Լ�����Ŀ������ ����
��4���Լ������������� �������з�����Ӧ�����ӷ���ʽΪ�� ����
��5��ijͬѧ��ȡ�ᴿ�IJ�Ʒ0.7759g���ܽ������100mL����ƿ�У�ÿ��ȡ25.00mL��Һ����0.1000mol?L��1������������Һ�ζ������εζ����ı���Һ��ƽ�����Ϊ25.62mL���ò�Ʒ�Ĵ���Ϊ�� ��������ʽ����������
��1�����ڣ�K2CO3ˮ�⣨2���Ȼ�����SO42��+Ba2+=BaSO4����CO32��+Ba2+=BaCO3������3��K2CO3��������BaCl2����4�����CO32��+2H+=CO2��+H2O����5��98.4%��
����������1��ǿ��������ˮ�����Һ������������Ũ�ȴ���������Ũ�ȣ���ˮ��Һ�ʼ��ԣ�
��2�����Ȼ�����Һ����ͬʱ��ȥ��������Ӻ�̼������ӣ��������ӷ���ʽ����д������д��
��3��Ϊ��ȥ�����ı�����ѡ��K2CO3���Լ��������ܳ�ȥ������ͬʱ�������Ȼ��أ�
��4������������ȥ������̼������ӣ��������ӷ���ʽ����д������д��ע��������ʺ�����д��ѧʽ��
��5���ȸ��������������ʵ�������25mL�Ȼ�����Һ�к��е��Ȼ��ص����ʵ������ټ���100mL�Ȼ�����Һ�к��е��Ȼ��ص����ʵ������Ӷ����������������������������ʽ�����������������ɣ�
��������
��1��̼�����ǿ����������ˮ�����Һ������������Ũ�ȴ���������Ũ�ȣ�������Һ�ʼ��ԣ�PH��7��
�ʴ�Ϊ�����ڣ�K2CO3ˮ�⣮
��2��Ҫ�������������������̼�����Ӧ����������Ȼ�����Һ��̼�������������ɲ�����ˮ�ı��Σ�ͬʱ�����Ȼ��أ����ӷ���ʽΪ��SO42��+Ba2+=BaSO4����CO32��+Ba2+=BaCO3����
�ʴ�Ϊ���Ȼ�����SO42��+Ba2+=BaSO4����CO32��+Ba2+=BaCO3����
��3��Ҫ��������ı����ӣ�Ҫ����̼��أ�̼��غ��Ȼ�����Ӧ����̼�ᱵ����ͬʱ�����Ȼ��أ����ӷ���ʽΪCO32��+Ba2+=BaCO3����
�ʴ�Ϊ��K2CO3��������BaCl2��
��4��Ҫ���������̼�����Ҫ�μ����������ᣬ̼������Ӻ����ᷴӦ���ɶ�����̼��ˮ�����ӷ���ʽΪCO32��+2H+=CO2��+H2O��
�ʴ�Ϊ�����CO32��+2H+=CO2��+H2O��
��5����25mL�Ȼ�����Һ���Ȼ��ص����ʵ���Ϊnmol��
KCl+AgNO3=AgCl+KNO 31mol 1mol
nmol 0.1000mol?L��1 ��0.02562L
n=0.002562mol
100mL��Һ�к����Ȼ��ص����ʵ���=0.002562mol��4=0.010248mol
100mL��Һ�к����Ȼ��ص�����=0.010248mol��74.5g/mol=0.764376g
��������=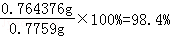 ��
��
�ʴ�Ϊ��98.4%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ�����Ͼ������棩 ���ͣ������
ͭ���ҹ���ɫ�������ϵ������н����������㷺��Ӧ���ڵ�������е���졢���������ش��������⣺
(1)ͭԭ�ӻ�̬�����Ų�ʽΪ ��
(2)�þ����x�������䷨���Բ�ð����ӵ��������Խ���ͭ�IJⶨ�õ����½��������Ϊ�����������ܶѻ����߳�Ϊ361 pm����֪ͭ���ܶ�Ϊ9.00g��cm-3����ͭ�����������
cm3�������������� g�������ӵ�����Ϊ (��ʽ���㣬��֪Ar(Cu)=63.6)��
(3)�Ⱥͼ��벻ͬ��̬��ͭ���������ֻ���������ֻ����ﶼ�����ڴ���Ȳ�ۺϣ��������Ӿ�Ϊ�������ṹ(����ͼ)��aλ����Clԭ�ӵ��ӻ��������Ϊ ����֪����һ�ֻ�����Ļ�ѧʽΪKCuCl3����һ�ֵĻ�ѧʽΪ ��

(4)����ͭ�����백ˮ����������ⶼ���ܷ�Ӧ�������백ˮ��������Ļ����Һ��Ӧ����ԭ���� ����Ӧ�Ļ�ѧ��Ӧ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ���¿α�����棩 ���ͣ�ѡ����
NA��ʾ����٤��������ֵ�����������в���ȷ����
A.��������ΪNA��NO2��CO2�Ļ�������к��е���ԭ����Ϊ2NA
B.28g��ϩ�ͻ����飨C4H8���Ļ�������к��е�̼ԭ����Ϊ2NA
C.���³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
D.���³�ѹ�£�22.4L����������þ�۳�ַ�Ӧ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ��ɽ���������棩 ���ͣ������
��12�֣���2012?ɽ����ʯ�ͺ�ú̿�ӹ������漰���ּ������豸��
��1��ʯ�ͷ���ʱ���ڲ������� �����ҵ�豸���ƣ���Ͷ��ԭ�ϵ�ͬʱ��ò�Ʒ���ù���Ϊ�� ���������̣�
��2��ʯ���ѻ���Ϊ���ѻ����� ���ͼ����ѻ����ѻ���Ŀ��������� ���IJ�����
��3��ú��ϴѡ��Ϊ�˽���ԭú�лҷֺ��� ���ĺ�����ú��������ȼ����ָ�����ӵײ�����ú̿��������ʹȫ��ú̿������ ������ȼ�յĹ��̣�
��4��ú��ֱ��Һ����ú���ʵ��ܼ���Ϻ��ڸ��º��� ������������ ����������Һ��ȼ�ϵĹ��̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ��ɽ���������棩 ���ͣ�ѡ����
��3�֣���2012?ɽ�����������л���Ľṹ�������йص�������ȷ���ǣ�������
A.������֬������ʹ����KMnO4��Һ��ɫ
B.�����Cl2�ķ�Ӧ����ϩ��Br2�ķ�Ӧ����ͬһ���͵ķ�Ӧ
C.�����ǡ����ǵķ���ʽ��ΪC6H12O6������Ϊͬ���칹��
D.�Ҵ������������Na��Ӧ�ų�H2�����߷����й�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ�����ȫ�������棩 ���ͣ�ѡ����
��2014?������һģ���٢ڢܼۢ��ֽ���Ƭ������������ϡ�����ж������ԭ��أ��٢�����ʱ�����·�����Ӣ�����٣��٢�����ʱ����Ϊ�������ڢ�����ʱ�������������ݳ����ۢ�����ʱ���۵��������٣��ݴ��ж������ֽ����������ɴ�С��˳���ǣ�������
A.�٢ۢڢ� B.�٢ۢܢ� C.�ۢܢڢ� D.�ۢ٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2014�Ĵ�ʡ�˲��д������п��Ը�һ��ѧ�Ծ��������棩 ���ͣ������
��17�֣���������һ�������մɲ��ϣ�������ʯӢ�����뽹̿�����ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2 + 6C + 2N2  Si3N4 + 6CO���÷�Ӧ�����е������仯��ͼ����ʾ���ش��������⣺
Si3N4 + 6CO���÷�Ӧ�����е������仯��ͼ����ʾ���ش��������⣺
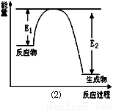
��1��������Ӧ�еĻ�ԭ���� ����ԭ������ ��
��2���÷�Ӧ�� ������ȡ����ȡ�����Ӧ��
��3����һ���¶��£�������Ӧ��4L�ܱ����������У���M��N�����������������ʵ�����ʱ��仯��������ͼ����ʾ��
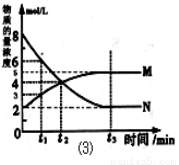
��M��N��ʾ�����ʷֱ�Ϊ �� ��
���Ƚ�t2ʱ�̣����淴Ӧ���ʴ�С ������
������  ���棩��
���棩��
���>������=������<������.
����t2=2min�����㷴Ӧ��ʼ��t2ʱ�̣�M��ƽ����ѧ��Ӧ����Ϊ ��
��t3ʱ�̻�ѧ��Ӧ�ﵽƽ��ʱ��Ӧ���ת����Ϊ ��
��4����ij����ȼ�ϵ�����ù�������������մ�������ʣ�ij�����Ϸ����ĵ缫��ӦΪ��A��H2��2e����O2��===H2O����A���ǵ�ص� �� (�����������)��
�������ϳ��������ķ�Ӧ������β�������ŷţ����������Ժ��������ͼ��ʾ����������β����CO�ĺ�������缫�м����������ﯡ�������Ϊ����ʣ����ֹ�����������O2-�����ͨ����������ԭ����ͼ����ʾ�����ж��Pt�缫a��b�ֱ�������CO��O2�����塣

��.�õ�ص�����Ϊ ����a��b����O2 ���� ���� ����������������
��.�õ�ص�������ӦʽΪ ��������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2014�Ĵ�ʡ�˲��д������п��Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���� �� ��
A��CO2��NH3��CCl4��N2 �У�����ԭ�Ӷ����������8���ӵ��ȶ��ṹ
B����Ԫ�����ڱ��н����ͷǽ������紦�����ҵ��뵼�����
C�����ۻ�������ܺ����Ӽ�
D������A��Ԫ�غ͵���A��Ԫ�ص�ԭ��֮�䶼���γ����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����ɫ����������Һ�У��ܴ���������������ǣ�������
A��Fe2����Na����Cl�D��NO3�D B��Ba2����Al3����Cl�D��NO3�D
C��K����Na����HCO3�D��Cl�D D��AlO2-��K����OH�D��Cl�D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com