
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
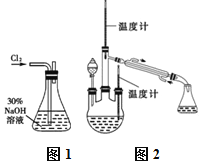
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
【答案】 ABE Cl2+2OH-=ClO-+ Cl-+H2O 三颈烧瓶 N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl
或CO(NH2)2+2NaOH+3NaClO = Na2CO3+N2 ↑ +3NaCl + 3H2O B 酸式 溶液出现蓝色且半分钟内不消失 9%
【解析】(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,胶头滴管等,故答案为:ABE;
(2)锥形瓶中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)根据图示可知,仪器A为三颈烧瓶;N2H4H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl,应将NaOH和NaClO混合溶液滴入CO(NH2)2溶液中,故分液漏斗中盛放的为NaOH和NaClO混合溶液,故答案为:三颈烧瓶;N2H4H2O+2NaClO=N2↑+3H2O+2NaCl;B;
(4)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中;肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,故答案为:酸式;溶液出现蓝色且半分钟内不消失;
②设馏分中水合肼(N2H4H2O)的质量分数为a,则:
N2H4H2O + 2I2=N2↑+4HI+H2O
50g 2mol
5g×a 0.018L×0.1mol/L×![]()
所以50g:5g×a=2mol:0.018L×0.1mol/L×![]() ,解得:a=9%,故答案为:9%。
,解得:a=9%,故答案为:9%。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是:
A. 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去
B. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和KCl溶液中滴加AgNO3溶液,最先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
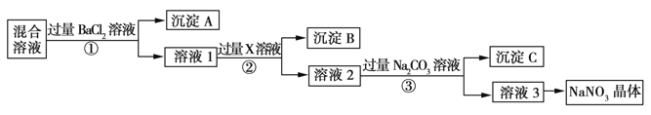
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X ,沉淀A 。
(2)上述实验流程中①②③步均要进行的实验操作是 (填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是 。
(4)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的 (填化学式),之后若要获得NaNO3晶体,需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 清洗试管内壁的MnO2可用热而浓的盐酸
B. 实验室存放少量白磷,应用冷水
C. 实验室制取氢气(用锌和稀硫酸)和氨气(用氯化钱和氢氧化钙),可使用同一套装置
D. 实验室收集NO时不能用排空气法,收集NO2时不能用排水法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
Ⅰ乳酸的工业生产可以采用生物发酵法,也可以采用有机合成法,其中的一种方法是丙酸法

(1)葡萄糖的结构简式为__________,检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a.溴水 b.银氨溶液 c.碘酒 d.碘化钾淀粉溶液
(2)丙酸合成法

①反应I的反应类型是___________,进行反应Ⅱ时,需要加入过量乙醇,这样做的目的是________。
②乳酸分子中有一个手性碳原子,通过两种反应可以使A中的手性碳原子失去手性。写出反应的化学方程式_____________________
Ⅱ“皂化值”是使1g 油脂皂化所需要的KOH的毫克数。某单甘油酯的皂化值数为190,通过计算可判断该油脂的名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是
A.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别可能为
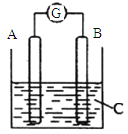
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是AgNO3稀溶液
D.A是Ag,B是Fe,C是AgNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol Na被完全氧化生成Na2O2,失去2NA个电子
B. 0.5mol锌粒与足量的盐酸反应产生H2为11.2L
C. 电解58.5g熔融的氯化钠,能产生23.0g金属钠、22.4L氯气(标准状况)
D. 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子键是阴离子与阳离子间的一种静电引力
B. 任何离子键在形成的过程中必定有电子的得与失
C. 带相反电荷的离子之间的相互吸引力称为离子键
D. 活泼非金属原子与活泼金属原子相遇时能形成离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com