
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂.
已知:氯化铜容易潮解.

实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜.

(1)石棉绒的作用是_________; E装置中的试剂是_____其作用____________ 。
(2)先点燃A处酒精灯,再点燃D处酒精灯的目的是______________________。
(3)若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是_____(一种即可)。
(4)溶解时加入HCl溶液的目的主要是__________________________(结合离子方程式回答).
【答案】增大铜粉与氯气的接触面积;浓H2SO4,防止水蒸气进入D装置中排除装置中的空气石棉绒(Cu或CuCl)(一种即可).Cu2+ + 2H2O![]() Cu(OH)2+2H+,加酸抑制Cu2+的水解。
Cu(OH)2+2H+,加酸抑制Cu2+的水解。
【解析】
(1)石棉绒的作用是增大铜粉与氯气反应的接触面积;E为浓硫酸,可防止空气中的水蒸气进入D中;因此本题答案是:增大铜粉与氯气的接触面积;浓H2SO4,防止水蒸气进入D装置中。
(2)先点燃A处酒精灯,反应产生氯气,利用产生的氯气排除装置中的空气后再点燃D处酒精灯;综上所述,本题答案是:排除装置中的空气。
(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种,也可能混有石棉绒,故答案为:石棉绒(Cu或CuCl)(一种即可)。
(4)因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2O![]() Cu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解;综上所述,本题答案是:Cu2+ + 2H2O
Cu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解;综上所述,本题答案是:Cu2+ + 2H2O![]() Cu(OH)2+2H+,加酸抑制Cu2+的水解。
Cu(OH)2+2H+,加酸抑制Cu2+的水解。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1,则C的燃烧热为△H =- 110.5 kJ·mol1
C. 25℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物的应用范围很广。下列说法正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.反应Si+2NaOH+H2O=Na2SiO3+2H2↑中,Si为氧化剂
D.硅能与氢氟酸反应,则硅可以与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
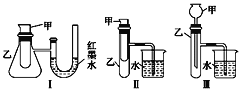
(1)上述3个装置中,不能证明“铜与浓硝 酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入 适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是______________,说明该反应属于_____ (填“吸热”或“放热”)反应。
(3)为定量测定(2)中反应的反应热,使50 mL 0.50 mol·L-1盐酸与50 mL0.55 mol·L-1NaOH溶液在简易量热计中进行中和反应.回答下列问题:
①该实验中NaOH的浓度大于HCl的浓度的作用是_________________________。
②实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 | C—H | C—F | H—F | F—F |
键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________;
(3) 表中元素⑤在周期表中的位置为____________________;
(4) 表中元素⑨和⑩最高价氧化对应水化物的酸性:__________>__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图像的说法正确的是

A. 图 1 表示:密闭容器中发生的反应 NH2COONH4(s) 2NH3(g)+CO2(g),NH3的体积分数 ψ(NH3)与时间(t)的关系
B. 图 2 表示:一定量饱和氯水中加入 CaCO3 固体,溶液中的 c(Cl-)与加入 CaCO3 物 质的量关系
C. 图3表示:NH4HSO4溶液中加入NaOH固体,溶液中的c(NH4+)与加入NaOH质量 的关系
D. 图4表示:25℃时,Na2S溶液加水稀释,溶液中的c(H+)与加入水的体积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,下列电离方程式正确的是
A.Al2(SO4)3=2Al3++3SO42-
B.AlCl3=Al3++Cl3-
C.Mg(NO3)2=Mg+2+2NO3-
D.KMnO4=K++Mn7++4O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 小苏打溶液呈弱碱性:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
C. pH=5的硫酸稀释1000倍,pH约等于7:H2O![]() H++OH-
H++OH-
D. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s)
SO42-(aq)+CaCO3(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com