
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO |
分析 A.氢氧化钠过量,铵根离子也与氢氧根离子反应;
B.物质的量相等时,氢氧根离子不足,氢离子优先反应,剩余的氢氧根离子与镁离子反应;
C.生成的是络合物硫氰化铁,不是沉淀;
D.二氧化硫少量,反应生成硫酸根离子、氯离子和次氯酸.
解答 解:A.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2,铵根离子和亚铁离子都参与反应,正确的离子方程式为:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故A错误;
B.等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合,HCl优先与氢氧化钡反应,剩余的氢氧根离子与镁离子反应,正确的离子方程式为:2H++Mg2++4OH-═Mg(OH)2↓+2H2O,故B错误;
C.用硫氰化钾溶液可以检验溶液中的Fe3+,二者反应生成硫氰化铁,正确的离子方程式为:Fe3++3SCN-═Fe(SCN)3,故C错误;
D.少量SO2通入NaClO溶液中,二者发生氧化还原反应,反应的离子方程式为:SO2+3ClO-+H2O═SO42-+Cl-+2HClO,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是描述微观粒子多少的物理量 | |
| B. | 物质的量将可称量的宏观物质与一定数目微观粒子联系起来 | |
| C. | 1molO2的质量为32g•mol-1 | |
| D. | 22.4L H2的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
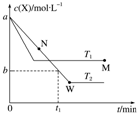 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A. | M点时再加入一定量X,平衡后X的转化率减小 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点放出的热量大于进行到W点放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
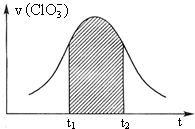 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )| A. | 开始时反应速率增大可能是由c(H+)增大所致 | |
| B. | 纵座标为v(H+)的v-t曲线与右图曲线完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 阴影部分面积可以表示t1-t2时间内c(Cl-)增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com