
| A. |  的结构中含有酯基 的结构中含有酯基 | |
| B. |  一定条件下与足量NaOH溶液反应,最多消耗3molNaOH 一定条件下与足量NaOH溶液反应,最多消耗3molNaOH | |
| C. | 按系统命名法,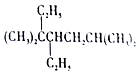 的名称为3,3,6-三甲基-4-乙基庚烷 的名称为3,3,6-三甲基-4-乙基庚烷 | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
分析 A.由端基原子、原子团可知, 为缩聚产物;
为缩聚产物;
B.含-Br、-HCOOC-及水解生成的酚-OH均与NaOH反应;
C.主链含7个C,3、6号C上有甲基,4号C上有乙基;
D.油脂含-COOC-,蛋白质含-CONH-,相对分子质量在10000以上的为高分子.
解答 解:A.由端基原子、原子团可知, 为缩聚产物,则结构中含有酯基,故A正确;
为缩聚产物,则结构中含有酯基,故A正确;
B.含-Br、-HCOOC-及水解生成的酚-OH均与NaOH反应,则一定条件下与足量NaOH溶液反应,最多消耗4molNaOH,故B错误;
C.主链含7个C,3、6号C上有甲基,4号C上有乙基,则名称为3,3,6-三甲基-4-乙基庚烷,故C正确;
D.油脂含-COOC-,蛋白质含-CONH-,相对分子质量在10000以上的为高分子,二者均可发生水解反应,而蛋白质为高分子,油脂不是,故D错误;
故选AC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
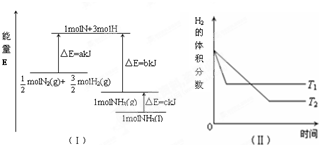
| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停业加热 | |
| B. | 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气 | |
| C. | 实验室制备CO气体必须在通风橱中进行 | |
| D. | 蒸馏操作时应在混合液中加入沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-═SO32-+H2O | |
| C. | 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com