
| A. | NaCl的电子式为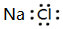 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |
分析 A.NaCl只含离子键,为离子化合物;
B.NaClO含Cl-O键;
C.状况未知,Vm不确定,不能计算物质的量;
D.滴加食醋,发生强酸制取弱酸的反应生成HClO.
解答 解:A.NaCl只含离子键,为离子化合物,其电子式为 ,故A错误;
,故A错误;
B.NaClO含Cl-O共价键及离子键,故B错误;
C.状况未知,Vm不确定,不能计算物质的量,则不能确定分子数,故C错误;
D.滴加食醋,发生强酸制取弱酸的反应生成HClO,发生的离子反应为ClO-+CH3COOH=HClO+CH3COO-,故D正确;
故选D.
点评 本题考查含氯化合物,为高频考点,把握物质的构成、化学键、离子反应为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁或液氯处理废水 | |
| B. | 用铁槽车或铝槽车运输浓硫酸 | |
| C. | 用二氧化硫或氯气漂自织物 | |
| D. | 用亚硫酸钠或氯水处理二氧化硫尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 油脂发生皂化反应能生成甘油 | |
| D. | 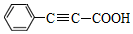 是高分子化合物 是高分子化合物 的单体 的单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
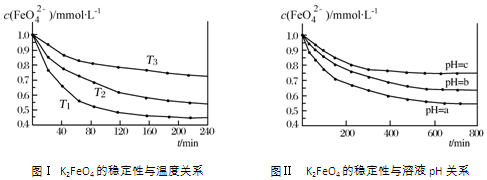
| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
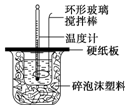 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com