
下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100 mL 2 mol/L的盐酸跟锌片反应时,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可缓慢反应生成N2和CO2,减小压强反应速率减慢
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知H+(aq) + OH-(aq) = H2O(1);ΔH = - 57. 3 kJ·mol-1,其中aq代表稀溶液,以下四个反应方程式中,反应热ΔH = - 57.3 kJ·mol-1的是( )
A. H2SO4(aq) +2NaOH(aq) = Na2SO4(aq)+ 2H2O(1)
B. 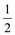 H2SO4(aq) +
H2SO4(aq) +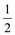 Ba(OH)2(aq) =
Ba(OH)2(aq) = 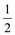 BaSO4(s)+ H2O(1)
BaSO4(s)+ H2O(1)
C. HCl(aq) +NaOH(aq) = NaCl(aq)+ H2O(1)
D. HCl(aq) + NH3 ·H2O (aq) = NH4Cl (aq) + H2O(1)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:选择题
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
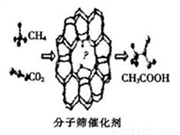
A. 消耗22.4 LCO2可制得1mol乙酸
B. 该反应过程符合“绿色化学”原理,其原子利用率为100%
C. 该反应属于取代反应
D. 反应物和生成物中均含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4+ 8H2O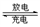 3Zn(OH)2+ 2Fe(OH)3+ 4KOH 。关于该电池的说法正确的是( )
3Zn(OH)2+ 2Fe(OH)3+ 4KOH 。关于该电池的说法正确的是( )
A. 放电时,Zn作负极,发生还原反应
B. 放电时,K2FeO4附近溶液pH减小
C. 充电时,锌极附近溶液pH减小
D. 充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-==FeO42-+4H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
对于化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);△H=a kJ/mol,下列叙述不正确的是( )
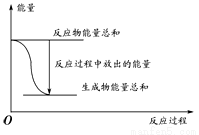
A. 反应过程中能量关系如上图表示,则该反应为放热反应
B. 若将该反应设计成原电池,锌为负极
C. 化学反应的焓变与反应方程式的计量数有关
D. 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
在一定条件下,使N2和H2在一密闭容器中进行反应,下列说法中不正确的是( )
A. 反应开始时,正反应速率最大,逆反应速率为0
B. 随着反应的进行,正反应速率逐渐减小,最后为0
C. 随着反应的进行,逆反应速率逐渐增大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:填空题
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2 6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________.
(3)将一定量的Fe2O3溶于160mL 5mol•L﹣1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为______.
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:实验题
A.[物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)Cu2+基态核外电子排布式为________,S、O、N三种元素的第一电离能由大到小为________。
(2)SO42-的立体构型是______,与SO42-互为等电子体的一种分子为_____(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________。
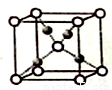
(4)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示,其中O2-的配位数是______________。
B.[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛 (实验装置见图,相关物质的沸点见附表)。其实验步骤为:
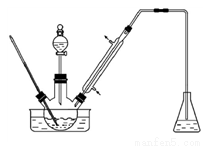
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_________。
(5)步骤4中采用减压蒸馏技术,是为了防止_____。
附表 相关物质的沸点(101kPa)
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二下学期开学考试化学试卷(解析版) 题型:选择题
下列各种叙述中正确的是
A. 在CH2=CH2分子中,存在4个σ键和一个π键
B. NH3、CO、CS2都是极性分子
C. N、O、F电负性大小:F>O>N;第一电离能大小:F>N>O
D. H2O的沸点比HF的沸点高,是由于水中氢键键能大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com