
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
分析 (1)加入200mL稀硝酸时,剩余9.6g金属,说明稀硝酸完全反应,则生成2240mL气体时消耗金属的质量为:18.0g-9.6g=8.4g,据此计算生成4480mL气体消耗金属的质量;
(2)第二组中稀硝酸完全反应,消耗16.8g金属,同时生成了4480mLNO,设铜、铁的物质的量为x、y,则①64x+56y=16.8,结合反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,反应生成NO为:②$\frac{2}{3}$(x+y)=$\frac{4.48L}{22.4L/mol}$,联立①②计算出金属的量,再结合反应计算出硝酸的物质的量及浓度;
(3)加入300mL稀硝酸时生成气体增加的物质的量为:$\frac{6.72L-4.48L}{22.4L/mol}$=0.1mol,消耗金属的物质的量为:0.1mol×$\frac{3}{2}$=0.15mol,消耗金属的平均摩尔质量为:$\frac{9.6g}{0.15mol}$=64g/mol,说明加入300mL硝酸时消耗的完全为铜,即混合金属中铜的物质的量为0.15mol,据此计算出铁与铜的物质的量之比;
(4)400mL该稀硝酸中含有硝酸的物质的量为:4mol/L×0.4L=1.6mol,根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O计算出铁完全反应生成硝酸铁消耗硝酸的物质的量,再计算出铜完全反应消耗硝酸的物质的量,根据计算结果判断硝酸过量情况,再计算出溶液中含有的硝酸根离子的物质的量.
解答 解:(1)加入200mL稀硝酸时,剩余9.6g金属,说明稀硝酸完全反应,则生成2240mL气体时消耗金属的质量为:18.0g-9.6g=8.4g,所以生成4480mL气体消耗金属的质量为:8.4g×2=16.8g,
故答案为:16.8;
(2)第二组中稀硝酸完全反应,消耗16.8g金属,同时生成了4480mLNO,设铜、铁的物质的量为x、y,则①64x+56y=16.8,结合反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,反应生成NO为:②$\frac{2}{3}$(x+y)=$\frac{4.48L}{22.4L/mol}$,联立①②解得:x=0、y=0.3mol,说明加入200mL稀硝酸时铜没有反应,只有0.3mol铁参与反应,则消耗硝酸的总物质的量为:0.3mol×$\frac{8}{3}$=0.8mol,该稀硝酸的浓度为:$\frac{0.8mol}{0.2L}$=4mol/L,
故答案为:4;
(3)加入300mL稀硝酸时生成气体增加的物质的量为:$\frac{6.72L-4.48L}{22.4L/mol}$=0.1mol,消耗金属的物质的量为:0.1mol×$\frac{3}{2}$=0.15mol,消耗金属的平均摩尔质量为:$\frac{9.6g}{0.15mol}$=64g/mol,说明加入300mL硝酸时消耗的完全为铜,即混合金属中铜的物质的量为0.15mol,所以铁与铜的物质的量之比为:0.3mol:0.15mol=2:1,
故答案为:2:1;
(4)400mL该稀硝酸中含有硝酸的物质的量为:4mol/L×0.4L=1.6mol,根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,0.3mol铁完全反应消耗硝酸的物质的量为:0.3mol×4=1.2mol,0.15mol铜完全反应消耗硝酸的物质的量为:0.15mol×$\frac{8}{3}$=0.4mol,总共需要消耗1.6mol硝酸,说明加入400mL稀硝酸后恰好反应,硝酸和金属恰好反应生成硝酸铜、硝酸铁,所以溶液中硝酸根离子的物质的量为0.3mol×3+0.15mol×2=1.2mol,
故答案为:1.2mol.
点评 本题考查了混合物反应的计算,题目难度较大,根据表中数据正确判断反应物过量情况为解答关键,注意明确金属与硝酸的反应原理,试题侧重考查学生的分析、理解能力及化学计算能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
 NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
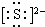 K+,⑤的结构式是O=C=O.
K+,⑤的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同分异构体 | |
| B. | 在一定的条件下,转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和分子晶体具有相同的物理性质和化学性质 | |
| D. | 在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(OH)}$ | C. | n(OH-)和c(H+) | D. | c(H+)和c(OH-)的乘积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com