
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 一束平行光线射入蛋白质溶液中,从侧面可以看到一束光亮的通路 | |
| C. | 黄河入海口形成了三角洲 | |
| D. | 将二氧化碳通入澄清石灰水中,一段时间后,石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
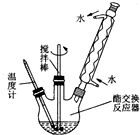 为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:
为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
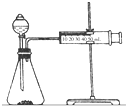 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- | |
| B. | 加HCl酸化的BaCl2有白色沉淀,一定有SO42- | |
| C. | 滴加硝酸酸化的AgNO3溶液没有白色沉淀,一定没有SO42- | |
| D. | 滴加BaCl2有白色沉淀,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gS03中含有的分子数为0.2NA | |
| B. | 常温下,30gSiO2晶体中含有Si--O键的数目为NA | |
| C. | 标准状况下,2.2 LCl2与足量水反应转移的电子数为0.1NA | |
| D. | 标准状况下,92.4 LNO与11.2LO2混合后所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 |
| 元素符号 | ①Na | ②Cl |
| 原子结构 示意图 |  | ③  |
| 周期 | 三 | 三 |
| 族 | ④IA | VII A |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com