
A.ClO2可用作消毒剂,是因为它具有强氧化性
B.等质量的ClO2和Cl2,在相同条件下ClO2的消毒效率高
C.现代工业中多用电解法制取ClO2,即![]() +4 H+====4ClO2↑+O2↑+2H2O(条件:电解),ClO2在阳极析出
+4 H+====4ClO2↑+O2↑+2H2O(条件:电解),ClO2在阳极析出
D.将ClO2+Mn2++H2O→MnO2↓+Cl-配平后,H2O的化学计量数为6
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
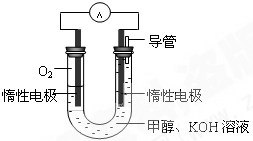 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
2- 4 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com