
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质 |
| B、因患“禽流感”而被捕杀的家禽尸体常用生石灰处理 |
| C、医疗上常用体积分数为75%的酒精进行皮肤消毒 |
| D、食品加工、消毒、防腐常使用福尔马林 |
查看答案和解析>>
科目:高中化学 来源: 题型:
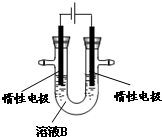 据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br-、Fe2+、I- |
| B、Br-、I-、Fe2+ |
| C、I-、Fe2+、Br- |
| D、Fe2+、I-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L一氯甲烷和二氯甲烷的混合物所含氯原子数介于NA至2NA之间 |
| B、1mol的Cu在一定条件下与足量硫粉反应,转移电子数目为2NA |
| C、3.65g液态氯化氢中分子的数目为0.1NA |
| D、常温下5.6g铁投入到足量的浓硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
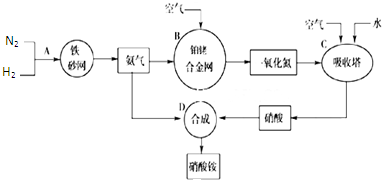
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com