
【题目】已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 84消毒液
[有效成分]NaClO
[规格]1000mL
[质量分数]25%
[密度]1.19gcm﹣3
(1)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 .
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力. ①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是 .
A.定容时俯视容量瓶刻度线
B.用量筒量取浓硫酸时俯视刻度线
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线.
E.加水时超过刻度线,用胶头滴管吸出.
【答案】
(1)0.04
(2)29.8;100mL容量瓶、胶头滴管
(3)4.6;250
(4)BDE
【解析】解:(1)密度1.19gcm﹣3 , 质量分数为25%的次氯酸钠的物质的量浓度C= ![]() =4.0 molL﹣1 , 次氯酸钠为强电解质,完全电离,钠离子的物质的量浓度等于次氯酸钠的物质的量浓度,则稀释后c(NaClO)=
=4.0 molL﹣1 , 次氯酸钠为强电解质,完全电离,钠离子的物质的量浓度等于次氯酸钠的物质的量浓度,则稀释后c(NaClO)= ![]() ×4.0 molL﹣1=0.04 molL﹣1 , 所以答案是:0.04;(2)应选取100 mL的容量瓶进行配制,然后取出80mL即可,所以需要NaClO的质量:0.1 L×4.0 molL﹣1×74.5 gmol﹣1=29.8g,配制80mL溶液,实验室没有该规格的容量瓶,所以应该选用100ml容量瓶;配制一定物质的量浓度的溶液步骤为:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀;所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,还缺少的玻璃仪器为:100mL容量瓶、胶头滴管, 所以答案是:29.8;100mL容量瓶、胶头滴管;(3)①c(H2SO4)=2.3molL﹣1 , 则c(H+)=4.6molL﹣1 , 所以答案是:4.6;②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=
×4.0 molL﹣1=0.04 molL﹣1 , 所以答案是:0.04;(2)应选取100 mL的容量瓶进行配制,然后取出80mL即可,所以需要NaClO的质量:0.1 L×4.0 molL﹣1×74.5 gmol﹣1=29.8g,配制80mL溶液,实验室没有该规格的容量瓶,所以应该选用100ml容量瓶;配制一定物质的量浓度的溶液步骤为:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀;所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,还缺少的玻璃仪器为:100mL容量瓶、胶头滴管, 所以答案是:29.8;100mL容量瓶、胶头滴管;(3)①c(H2SO4)=2.3molL﹣1 , 则c(H+)=4.6molL﹣1 , 所以答案是:4.6;②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c= ![]() =18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,所以答案是:250;(4)A.定容时俯视容量瓶刻度线,导致稀溶液体积偏小,浓度偏高,故A错误;
=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,所以答案是:250;(4)A.定容时俯视容量瓶刻度线,导致稀溶液体积偏小,浓度偏高,故A错误;
B.用量筒量取浓硫酸时俯视刻度线,量取的浓硫酸体积偏小,浓度偏低,故B正确;
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液,因配制过程中需要滴加蒸馏水定容,故此无影响,故C错误;D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线,导致稀溶液体积偏大,则浓度偏低,故D正确;E.加水时超过刻度线,用胶头滴管吸出,吸出的溶液中含有溶质,所以浓度偏低,故E正确;故选BDE.
【考点精析】利用配制一定物质的量浓度的溶液对题目进行判断即可得到答案,需要熟知配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】完成下列有关反应的化学方程式,并注明有关反应条件:
(1)2-溴丙烷消去反应方程式________________________________;
(2)1,3-丁二烯的加聚反应方程式____________________________;
(3)CH3CH2CHO与新制Cu(OH)2反应的方程式_________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l)=H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
A.使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OCH3从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+ 2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①合成甲醇的反应为_______(填 “放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________。
③达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
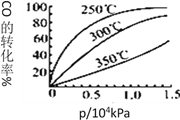
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能够大量共存的是( )
A. K+、Na+、OH-、Cl- B. Na+、Mg2+、SO42-、OH-
C. H+、Ca2+、Cl-、CO32- D. Cu2+、Ba2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①CH3OH(l)+O2(g )= CO(g)+2H2O(g) △H= - 354.8 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
请写出甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________。
(2)某实验小组利用H2(g)、O2(g)、KOH(aq)设计成电池装置(装置Ⅰ),通过装置Ⅱ实现铁棒上镀铜。

①装置Ⅰ中,a口通入的气体为____________(填“H2”或“O2”),放电时,溶液中的K+向______极移动(填“正”或“负”),该电池负极的电极反应式为______________________。
②装置Ⅱ中,溶液c可选用________________溶液。
若电镀结束后,装置Ⅱ中Fe电极的质量改变了12.8g,则装置Ⅰ中理论上消耗氧气的体积为________L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。己知:酸性条件下,锡在水洛液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化、易水解生成碱式氯化亚锡(Sn(OH)Cl);SnCl4极易水解。请按要求回答下列相关问题:
(1)锡原子的核电荷数为50,锡的原子结构示意图为________________。
(2) SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因____________。
SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为______________。
(3)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: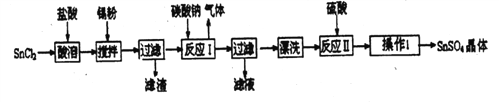
①操作Ⅰ是___________。
②加入Sn粉的作用有两个:a.调节溶液pH; b.__________.
③反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______________。
(4)锡粉可用于微电子器件生产,该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将1.2g试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2↑;②加入过量的FeCl3;③用0.1 mol/L的K2Cr2O7滴定生成的Fe2+ (己知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液32mL。则锡粉中锡的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。

下列说法错误的是
A. 甲同学认为步骤1中使用1,2-二氯乙烷的目的是做催化剂,加快反应速率
B. 乙同学认为可在该实验装置的冷凝管后加接一只装有无水MgSO4的干燥管,实验效果可能会更好
C. 丙同学认为步骤2中有机相使用10%NaHCO3溶液洗涤可除去大部分未反应完的Br2
D. 丁同学认为步骤4中减压蒸馏有机相是因为间溴苯甲醛高温下容易氧化或分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com