
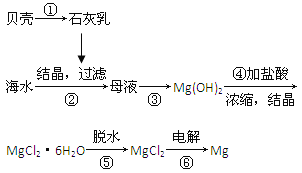
【题目】从海水中提取镁的工艺流程可表示如下:
下列说法不正确的是( )。
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
【答案】B
【解析】
从海水中提取镁的工艺流程:利用贝壳分解生成氧化钙CaCO3 ![]() CaO+CO2↑,溶于水得到氢氧化钙CaO+H2O═Ca(OH)2,加入到母液中沉淀镁离子Mg2++2OH -=Mg(OH)2↓,过滤得到氢氧化镁沉淀,加入盐酸溶解富集镁元素2HCl+Mg(OH)2═MgCl2+2H2O,通过浓缩、蒸发冷却结晶的方法得到氯化镁晶体,在氯化氢气流中脱水得到氯化镁固体,电解熔融氯化镁制备镁MgCl2
CaO+CO2↑,溶于水得到氢氧化钙CaO+H2O═Ca(OH)2,加入到母液中沉淀镁离子Mg2++2OH -=Mg(OH)2↓,过滤得到氢氧化镁沉淀,加入盐酸溶解富集镁元素2HCl+Mg(OH)2═MgCl2+2H2O,通过浓缩、蒸发冷却结晶的方法得到氯化镁晶体,在氯化氢气流中脱水得到氯化镁固体,电解熔融氯化镁制备镁MgCl2![]() Mg+Cl2↑。
Mg+Cl2↑。
A.海水中镁元素含量高,原料来源于海水,提取镁原料来源丰富,故A正确;
B.电解熔融MgCl2可得到金属镁,镁离子在阴极放电,电极反应方程式为:Mg2++2e-=Mg,故B错误;
C.MgCl26H2O在一定条件下加热得到无水MgCl2,若直接加热MgCl26H2O,会促进Mg2+水解,得不到无水MgCl2,因Mg2+水解呈酸性,在氯化氢气流中可抑制Mg2+水解,同时带走水蒸气,故一定条件为在HCl气流中,目的是抑制Mg2+水解,故C正确;
D.上述工艺流程中涉及②为分解反应③为化合反应,④为复分解反应,⑤⑥为复分解反应,⑦为分解反应,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法错误的是( )
A. 4.6g由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA
B. 0.2gD216O中含有的质子数,中子数,电子数均为0.1NA
C. 6.2克白磷分子(P4)中含P—P键为0.05NA
D. 铁与足量稀硝酸反应时,生产0.1molNO转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
Ⅰ![]() 铅蓄电池充放电的总反应为:
铅蓄电池充放电的总反应为:![]()
![]()
![]() ,锂硫电池充放电的总反应为:
,锂硫电池充放电的总反应为:![]()
![]()
![]() .
.
![]() 放电时,铅蓄电池的负极反应式为 ______ .
放电时,铅蓄电池的负极反应式为 ______ .
![]() 锂硫电池工作时,电子经外电路流向 ______
锂硫电池工作时,电子经外电路流向 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() .
.
![]() 当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
Ⅱ![]() 由方铅矿
由方铅矿![]() 制备铅蓄电池电极材料
制备铅蓄电池电极材料![]() 的方法如下:
的方法如下:

![]() 油画所用的白色颜料
油画所用的白色颜料![]() 置于空气中,遇
置于空气中,遇![]() 气体变成黑色PbS,从而使油画的色彩变暗,用
气体变成黑色PbS,从而使油画的色彩变暗,用![]() 清洗,可使油画“复原”.
清洗,可使油画“复原”.
![]() 的作用是 ______.
的作用是 ______.
![]() 已知硫化铅溶于水时存在溶解平衡:
已知硫化铅溶于水时存在溶解平衡:![]() ,试分析
,试分析![]() 能溶于稀
能溶于稀![]() 的原因 ______.
的原因 ______.
![]() 滤液X是一种可循环使用的物质,其溶质主要是 ____
滤液X是一种可循环使用的物质,其溶质主要是 ____ ![]() 填化学式
填化学式![]() ,若X中残留的
,若X中残留的![]() 过多,循环使用时可能出现的问题是 ____.
过多,循环使用时可能出现的问题是 ____.
![]() 与次氯酸钠溶液反应可制得
与次氯酸钠溶液反应可制得![]() ,写出该反应的离子方程式 ______ .
,写出该反应的离子方程式 ______ .
![]() 以石墨为电极,电解
以石墨为电极,电解![]() 溶液也可以制得
溶液也可以制得![]() ,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在
,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在![]() 溶液中加入适量
溶液中加入适量![]() ,理由是 ______ .
,理由是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
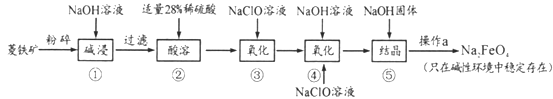
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
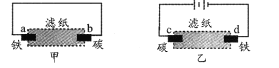
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
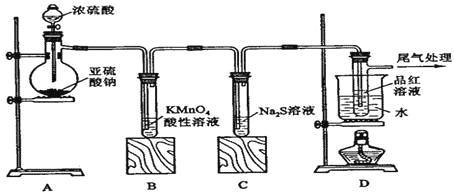
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列仪器组装一套石油分馏的装置,并进行相关实验,可以得到汽油和煤油。
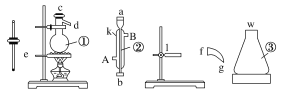
(1)写出下列仪器的名称:
①________;②________;③________。
(2)将以上仪器按从左到右的顺序,用字母a、b、c……进行连接:e接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)。
(3)仪器②中A是________(填“进水口”或“出水口”,下同),B是________。
(4)蒸馏时,温度计水银球应在________(位置)。
(5)在①中注入原油后,加几片碎瓷片的目的是_______
(6)在实验结束后,为了探究石油中是否含有烯烃,某学生用③中的物质做了一个探究实验,其操作、现象及结论是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制0.1 mol/L的NaOH溶液450 ml,下列说法正确的是( )
A.用托盘天平称量固体的质量为1.8 g
B.称量NaOH固体时可在烧杯中进行
C.定容时仰视读数所得溶液的浓度偏大
D.当液面在刻度线下2-3 mm时,换用胶头滴管滴加蒸馏水定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com