
 ĢśŹĒÉś²śÉś»īÖŠÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£¬Į¶Ģś¼¼Źõ±øŹÜ¹Ų×¢£¬ŅŃÖŖ£ŗ
ĢśŹĒÉś²śÉś»īÖŠÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£¬Į¶Ģś¼¼Źõ±øŹÜ¹Ų×¢£¬ŅŃÖŖ£ŗ| ±ąŗÅ | ČŻĘ÷ | ĘšŹ¼Ź±ĪļÖŹµÄĮæ mol | Ę½ŗāŹ±ĪļÖŹµÄĮæ/mol | Ę½ŗā³£Źż£ØK£© | |
| ””Fe2O3 | ””CO | Fe”” | |||
| 1 | ŗćĪĀ | ””0.5 | 1.5”” | ””0.8 | K1 |
| 2 | ŗćĪĀ | ””2 | ””3 | ””m | K2 |
| 3 | ¾ųČČ | ””1 | ””1.5 | ””n | K3 |
·ÖĪö £Ø1£©øł¾ŻøĒĖ¹¶ØĀÉŗĶ½įŗĻ·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõÉś³ÉĪļµÄ×ܼüÄÜĮŠ·½³Ģ¼ĘĖćæÉĒó³ö£»
£Ø2£©Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬¹Źa=b£»
£Ø3£©¢ŁŅĄ¾Ż»ÆŃ§Ę½ŗāČż¶ĪŹ½¼ĘĖćĘ½ŗāÅØ¶Č£¬½įŗĻĘ½ŗā³£ŹżøÅÄī¼ĘĖćµĆµ½£»
¢Śøł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖć·“Ó¦ĖŁĀŹ£»
¢Ūøł¾Ż»ÆŃ§Ę½ŗāČż¶ĪŹ½¼ĘĖćŗĶµČŠ§Ę½ŗāČ„·ÖĪö£»
£Ø4£©øł¾ŻĶ¼ĻóæÉÖŖ£¬6minŹ±£¬øıäĢõ¼žĻĀCOÅضČĮ¢æĢŌö“󔢶žŃõ»ÆĢ¼Į¢æĢÅØ¶Č¼õŠ”£¬ĖµĆ÷Ę½ŗāĻņ×ÅÄęĻņŅĘ¶Æ£¬½įŗĻĄÕĻÄĢŲĮŠŌĄķ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻøĒĖ¹¶ØĀÉ£¬½«¢Ł”Į$\frac{1}{3}$-¢Ś”Į$\frac{2}{3}$µĆ£ŗC£Øs£©+CO2£Øg£©=2CO£Øg£©”÷H=£Ø+460.5KJ•mol-1£©”Į$\frac{1}{3}$+£Ø-28.5KJ•mol-1£©”Į$\frac{2}{3}$=172.5kJ•mol-1£®Éč¶ĻĮŃ1mol C£Øs£©ÖŠĖłÓŠ»Æѧ¼üŠčŅŖĪüŹÕµÄÄÜĮæĪŖx£¬Ōņ£ŗx=2”Į1076kJ-1490kJ+172.5kJ=834.5kJ£¬
¹Ź“š°øĪŖ£ŗ834.5kJ£»
£Ø2£©Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬T1”ꏱ£¬K=c£ØCO2£©=amol/L£¬¹ŹĘäĖūĢõ¼ž²»±ä£¬ĖõŠ”ČŻĘ÷ČŻ»ż£¬ŌŁ“Ī“ļµ½Ę½ŗāŹ±£¬CO2µÄÅضČĪŖb mol•L-1£¬k=b mol•L-1£¬¹Źa=b£¬
¹Ź“š°øĪŖ£ŗ=£»
£Ø3£©¢ŁŅĄ¾Ż·“Ó¦¢ŚČČ»Æѧ·½³ĢŹ½¼ĘĖć£»
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©”÷H=-28.5KJ•mol-1
ĘšŹ¼Įæ£Ømol£© 0.5 1.5 0 0
±ä»ÆĮæ£Ømol£© 0.4 1.2 0.8 1.2
Ę½ŗāĮæ£Ømol£©0.1 0.3 0.8 1.2
Ōņ»ÆŃ§Ę½ŗā³£ŹżK1=$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$=$\frac{£Ø\frac{1.2}{10}£©^{3}}{£Ø\frac{0.3}{10}£©^{3}}$=64£¬
¹Ź“š°øĪŖ£ŗ64£»
¢ŚÉč5min“ļµ½Ę½ŗāŹ±CO2µÄĪļÖŹµÄĮæĪŖxmol
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©”÷H=-28.5KJ•mol-1
ĘšŹ¼Įæ£Ømol£© 2 3 0 0
±ä»ÆĮæ£Ømol£© x/3 x 2x/3 x
Ę½ŗāĮæ£Ømol£©2-x/3 3-x 2x/3 x
K2=K1=$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$=64=$\frac{£Ø\frac{x}{10}£©^{3}}{£Ø\frac{3-x}{10}£©^{3}}$£¬
½āµĆ£ŗx=2.4mol
v£ØCO2£©=$\frac{\frac{2.4mol}{10L}}{5min}$=0.048mol/£ØL•min£©£¬
¹Ź“š°øĪŖ£ŗ0.048mol/£ØL•min£©£»
¢ŪA£® Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©”÷H=-28.5KJ•mol-1
ĘšŹ¼Įæ£Ømol£© 2 3 0 0
±ä»ÆĮæ£Ømol£© m/3 m 2m/3 m
Ę½ŗāĮæ£Ømol£©2-m/3 3-m 2m/3 m
K2=K1=$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$=64=$\frac{£Ø{\frac{m}{10}£©}^{3}}{£Ø\frac{3-m}{10}£©^{3}}$£¬
½āµĆ£ŗm=2.4mol
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©”÷H=-28.5KJ•mol-1
ĘšŹ¼Įæ£Ømol£© 1 1.5 0 0
±ä»ÆĮæ£Ømol£© n/3 n 2n/3 n
Ę½ŗāĮæ£Ømol£©1-n/3 1.5-n 2n/3 n
K2=K1=$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$=64=$\frac{£Ø\frac{n}{10}£©^{3}}{£Ø{\frac{3-n}{10}£©}^{3}}$£¬
½āµĆ£ŗn=1.2mol£¬
øł¾Ż·ÖĪöæÉÖŖ£¬m=2n£¬¹ŹA“ķĪó£»
B£®øł¾Ż¢Ł¢ŚµÄŹż¾ŻæÉÖŖ£ŗ
a1=$\frac{1.2}{1.5}$”Į100%=80%£¬a2=$\frac{2.4}{3}$”Į100%=80%£¬Ōņa1=a2£¬¹ŹB“ķĪó£»
C£®ŅņĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£Źż²»±ä£¬ŌņK1=K3£¬¹ŹCÕżČ·£»
D£®Ņņn=1.2mol£¾0.8mol£¬ŌņĘ½ŗāŹ±ĘųĢåŃ¹Ēæ£ŗP3£¾P1£¬¹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗCD£»
£Ø4£©6minŹ±£¬øıäĢõ¼žĻĀCOÅضČĮ¢æĢŌö“󔢶žŃõ»ÆĢ¼Į¢æĢÅØ¶Č¼õŠ”£¬ĖµĆ÷øıäĢõ¼žÉżøßĪĀ¶ČŗóĘ½ŗāĻņ×ÅÄęĻņŅĘ¶Æ£¬
¹Ź“š°øĪŖ£ŗÉżĪĀ£»ÉżĪĀ£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬COÅضČŌö“ó£¬CO2ÅØ¶Č¼õŠ”£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éę¼°»ÆŃ§Ę½ŗā¼ĘĖć”¢øĒĖ¹¶ØĀɵÄÓ¦ÓĆ”¢»ÆŃ§Ę½ŗā¼°ĘäÓ°ĻģµČÖŖŹ¶£¬ĢāÄæÄŃ¶Č½Ļ“ó£¬×¢ŅāĘ½ŗā³£Źż¼ĘĖ揱ŅŖÓĆÅØ¶Č¶ų²»ŹĒĪļÖŹµÄĮ棬ĪŖŅדķµć£¬ŹŌĢāÓŠĄūÓŚÅąŃųѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 ÖĒÄÜѵĮ·Į·²āæ¼ĻµĮŠ“š°ø
ÖĒÄÜѵĮ·Į·²āæ¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØSO2£©=0.25 mol•L-1 | B£® | c£ØO2£©=0.12 mol•L-1 | ||
| C£® | c£ØSO2£©+c£ØSO3£©=0.15 mol•L-1 | D£® | c£ØSO3£©+c£ØO2£©=0.3 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
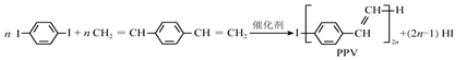
| A£® | ŗĻ³ÉPPVµÄ·“Ó¦ĪŖ¼Ó¾Ū·“Ó¦ | |
| B£® | PPVÓė¾Ū±½ŅŅĻ©¾ßÓŠĻąĶ¬µÄÖŲø“½į¹¹µ„ŌŖ | |
| C£® | H2CØTCH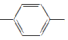 CHØTCH2ŗĶ±½ŅŅĻ©»„ĪŖĶ¬ĻµĪļ CHØTCH2ŗĶ±½ŅŅĻ©»„ĪŖĶ¬ĻµĪļ | |
| D£® | ĶعżÖŹĘ׷زā¶ØPPVµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮ棬æɵĆĘä¾ŪŗĻ¶Č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ōö¼ÓH2µÄĮæ | |
| B£® | ½«ČŻĘ÷Ģå»żĖõŠ”Ņ»°ė | |
| C£® | ±£³ÖČŻĘ÷ÄŚĢå»ż²»±ä£¬³äČėArŹ¹ĢåĻµŃ¹ĒæŌö“ó | |
| D£® | ³äČėAr£¬±£³ÖČŻĘ÷ÄŚŃ¹Ēæ²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĶĘ¹ćŹ¹ÓĆĆŗµÄŅŗ»Æ¼¼Źõ£¬“Óøł±¾ÉĻ¼õÉŁ¶žŃõ»ÆĢ¼µČĪĀŹŅŠ§Ó¦µÄÅÅ·Å | |
| B£® | ½ŗĢåŗĶČÜŅŗµÄ±¾ÖŹĒų±šŹĒ½ŗĢå¾ßÓŠ¶”“ļ¶ūĻÖĻó | |
| C£® | SiO2¼ČÄÜÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ÓÖÄÜÓėĒā·śĖį·“Ó¦£¬SiO2ŹĒĮ½ŠŌŃõ»ÆĪļ | |
| D£® | Ź¹ÓĆŗ¬ÓŠĀČ»ÆøʵÄČŚŃ©¼Į»į¼ÓĖŁĒÅĮŗµÄøÆŹ“ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ·Ø¹ś”¢ĆĄ¹ś”¢ŗÉĄ¼µÄČżĪ»æĘѧ¼ŅŅņŃŠ¾æ”°·Ö×Ó»śĘ÷µÄÉč¼ĘÓėŗĻ³É”±»ńµĆ2016ÄźÅµ±“¶ū»Æѧ½±£ŗĀÖĶéŹĒŅ»ÖÖ·Ö×Ó»śĘ÷µÄŅ»ÖÖ·Ö×Ó»śĘ÷µÄ”°ĀÖ×Ó”±£¬ĀÖĶéµÄŅ»ÖÖŗĻ³ÉŌĮĻÓÉC”¢H”¢OČżÖÖŌŖĖŲ×é³É£¬ĘäĒņ¹÷Ä£ŠĶČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
·Ø¹ś”¢ĆĄ¹ś”¢ŗÉĄ¼µÄČżĪ»æĘѧ¼ŅŅņŃŠ¾æ”°·Ö×Ó»śĘ÷µÄÉč¼ĘÓėŗĻ³É”±»ńµĆ2016ÄźÅµ±“¶ū»Æѧ½±£ŗĀÖĶéŹĒŅ»ÖÖ·Ö×Ó»śĘ÷µÄŅ»ÖÖ·Ö×Ó»śĘ÷µÄ”°ĀÖ×Ó”±£¬ĀÖĶéµÄŅ»ÖÖŗĻ³ÉŌĮĻÓÉC”¢H”¢OČżÖÖŌŖĖŲ×é³É£¬ĘäĒņ¹÷Ä£ŠĶČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | øĆ»ÆŗĻĪļµÄĆū³ĘĪŖŅŅĖįŅŅõ„ | |
| B£® | øĆ»ÆŗĻĪļæÉŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬ĒŅ·“Ó¦ĄąŠĶĻąĶ¬ | |
| C£® | øĆ»ÆŗĻĪļ¼ČÄÜ·¢ÉśČ”“ś·“Ó¦£¬ÓÖÄÜ·¢Éś¼Ó³É·“Ó¦ŗĶŃõ»Æ·“Ó¦ | |
| D£® | øĆ»ÆŗĻĪļµÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬ÄÜÓėNaHCO3·“Ó¦·Å³öCO2µÄÖ»ÓŠ2ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | N2 ŗĶ CO | B£® | CO2 ŗĶ N2O | C£® | O3 ŗĶ CO2 | D£® | CO32- ŗĶ NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ½«Ņ»æéÖŹĮæĪŖ5.0gµÄĀĮʬĶ¶ČėŹ¢ÓŠ500mL 0.5mol•L-1ĮņĖįČÜŅŗµÄÉÕ±ÖŠ£¬øĆĀĮʬÓėĮņĖį·“Ó¦²śÉśĒāĘųµÄĖŁĀŹÓė·“Ó¦Ź±¼äµÄ¹ŲĻµæÉÓĆČēĶ¼ĖłŹ¾µÄĒśĻߥ“±ķŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
½«Ņ»æéÖŹĮæĪŖ5.0gµÄĀĮʬĶ¶ČėŹ¢ÓŠ500mL 0.5mol•L-1ĮņĖįČÜŅŗµÄÉÕ±ÖŠ£¬øĆĀĮʬÓėĮņĖį·“Ó¦²śÉśĒāĘųµÄĖŁĀŹÓė·“Ó¦Ź±¼äµÄ¹ŲĻµæÉÓĆČēĶ¼ĖłŹ¾µÄĒśĻߥ“±ķŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+”¢Na+”¢SO42-”¢HCO3- | B£® | K+”¢Na+”¢Cl-”¢SO42- | ||
| C£® | K+”¢Cu2+”¢NO3-”¢SO42- | D£® | K+”¢Fe2+”¢NO3-”¢Cl- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com