
分析 根据BaSO4溶液中存在的沉淀溶解平衡BaSO4(s)?Ba2+(aq)+SO42-(aq)可知,Ksp(BaSO4)=c(Ba2+)•(SO42-),且c(Ba2+)=(SO42-),据此可计算出溶液中溶解的硫酸钡的物质的量浓度,再根据S=$\frac{溶质的质量}{溶剂的质量}$×100g计算;
解答 解:根据BaSO4溶液中存在的沉淀溶解平衡BaSO4(s)?Ba2+(aq)+SO42-(aq)可知,Ksp(BaSO4)=c(Ba2+)•(SO42-),且c(Ba2+)=(SO42-),所以溶液中c(BaSO4)=(SO42-)=$\sqrt{{K}_{sp}{\;}_{(BaS{O}_{4)}}}$=1.05×10-5mol•L-1,设溶液的体积为1L,则溶液中水的质量约为1000g,所含有硫酸钡的物质的量为1.05×10-5mol,所以硫酸钡的溶解度=$\frac{1.05×1{0}^{-5}×233}{1000}$×100g=2.44×10-4g,
答:25℃时BaSO4的溶解度为2.44×10-4g.
点评 本题考查了难溶电解质的溶解平衡常数与溶解度的相关计算,难度不大,注意根据溶度积常数计算离子浓度,再利用溶解度公式计算;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应Fe+4HNO3=Fe(NO3)2+2NO2↑+2H2O可知:反应中HNO3表现酸性和氧化性
C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3+3H+,生成的胶体能吸附水中的悬浮物,从而达到净水目的.
Al(OH)3+3H+,生成的胶体能吸附水中的悬浮物,从而达到净水目的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
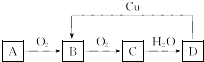
| A. | 氯 | B. | 铁 | C. | 碳 | D. | 氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
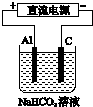 某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.
某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
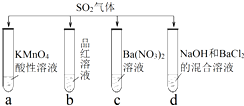
| A. | 试管a中实验可以证明具有漂白性 | |
| B. | 试管b中溶液褪色,说明具有强氧化性 | |
| C. | 试管c中能产生白色沉淀,说明具有还原性 | |
| D. | 试管d中能产生白色沉淀,该沉淀完全溶于 稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com