
 (1)如图是某煤化工产业链的一部分:
(1)如图是某煤化工产业链的一部分:分析 (1)产业链中某反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,反应的化学方程式为:H2O(g)+C(s)?H2(g)+CO(g),已知此反应中生成1g氢气需吸热65.75KJ,生成2g氢气放热=65.75KJ×2=131.5KJ,结合热化学方程式书写方法写出,标注物质聚集状态和对应反应的焓变;
(2)①自发进行的判断依据是△H-T△S<0,结合反应特征分析判断需要的条件;
②可能反应到达平衡时,正逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡.
解答 解:(1)产业链中某反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,反应是碳和水蒸气反应生成氢气和一氧化碳,反应的化学方程式为:H2O(g)+C(s)?H2(g)+CO(g),已知此反应中生成1g氢气需吸热65.75KJ,生成2g氢气放热=65.75KJ×2=131.5KJ,结合热化学方程式书写方法写出,标注物质聚集状态和对应反应的焓变,反应的热化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.5 KJ/mol,
故答案为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.5 KJ/mol;
(2)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△H-T△S<0,
故答案为:低温;
②CO2(g)+3H2(g)═CH3OH(l)+H2O(l),
A、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,所以混合气体的平均相对分子质量始终保持不变,不能说明反应达到平衡状态,故A错误;
B、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,所以过程中CO2和H2的体积分数始终保持不变,故B错误;
C、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故C错误;
D、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故D正确;
故答案为:D.
点评 本题考查了化学反应原理的分析,反应化学方程式和平衡常数的关系,热化学方程式书写方法和反应自发性的判断、化学平衡状态判断,难度中等,注意基础知识的积累.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
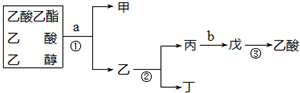
| A. | 甲是乙酸乙酯 | |
| B. | ①、②操作都是蒸馏 | |
| C. | a试剂是饱和Na2CO3溶液 | |
| D. | 制备乙酸乙酯时加试剂的顺序是:乙醇、浓硫酸、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②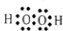 ③
③ ④
④ ⑤
⑤ ⑥
⑥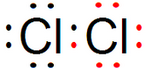 ⑦
⑦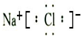
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变、减小 | B. | 增大、减小 | C. | 减小、增大 | D. | 不变、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com