
A.沸腾炉 B.接触室 C.吸收塔 D.尾气吸收
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:阅读理解
| 气体 | SO2 | N2 | O2 |
| 物质的量 | 10 | 58 | 6 |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源:新疆自治区模拟题 题型:填空题
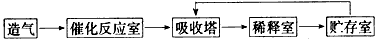
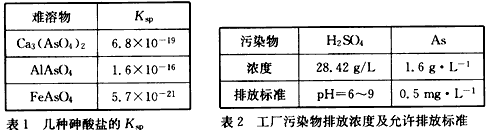
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com