
在反应aA(g)+bB(g) cC(g)的平衡体系中,无论升高温度或降低压强,C的浓度都会增大,则以下说法正确的是
cC(g)的平衡体系中,无论升高温度或降低压强,C的浓度都会增大,则以下说法正确的是
| A.a+b<c正反应吸热 | B.a+b>c正反应吸热 |
| C.a+b>c正反应放热 | D.a+b<c正反应放热 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 催化剂 |
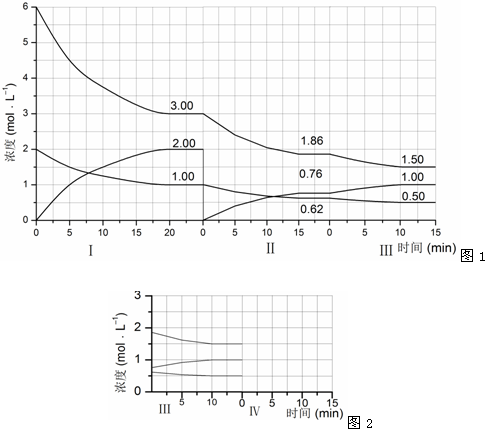
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
在反应aA(g)+bB(g) cC(g)的平衡体系中,无论升高温度或降低压强,C的浓度都会增大,则以下说法正确的是
cC(g)的平衡体系中,无论升高温度或降低压强,C的浓度都会增大,则以下说法正确的是
A.a+b<c正反应吸热 B.a+b>c正反应吸热
C.a+b>c正反应放热 D.a+b<c正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
 cC(g)+dD(g)中,若开始反应时只充入了C和D,则在达到平衡前的前t秒内一定有v正_____________v逆,假定c(A)增大了n/vmol/L,那么在此反应过程中使c(B)_____________了_______,使c(C)_______了_______,用c(D)的变化表示该反应的速率为___________。
cC(g)+dD(g)中,若开始反应时只充入了C和D,则在达到平衡前的前t秒内一定有v正_____________v逆,假定c(A)增大了n/vmol/L,那么在此反应过程中使c(B)_____________了_______,使c(C)_______了_______,用c(D)的变化表示该反应的速率为___________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com