
| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ag(NH3)2]Cl、K[Ag(CN)2] | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)4]SO4 | D. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl |
分析 配合物中,配离子:含有配位键的离子,可以是阳离子或阴离子;
内界、外界:内界指配位单元,外界与内界相对;
配位体:提供孤电子对的分子或离子;
配位原子:配体中,提供电子对的原子;
中心原子:一般指接受电子对的原子;
配位数:中心原子周围的配位原子个数,据此分析解答.
解答 解:A.K[Ag(CN)2]中中心离子是Ag+,电荷数为+1,配位数为2;[Cu(NH3)4]SO4中中心离子是Cu2+,电荷数为+2,配位数为4,故A错误;
B.[Ag(NH3)2]Cl中中心离子是Ag+,电荷数为+1,配位数为2;K[Ag(CN)2]中中心离子是Ag+,电荷数为+1,配位数为2,故B正确;
C.[Ag(NH3)2]Cl中中心离子是Ag+,电荷数为+1,配位数为2;[Cu(NH3)4]SO4中中心离子是Cu2+,电荷数为+2,配位数为4,故C错误;
D.[Ni(NH3)4]Cl2中中心离子是Ni2+,电荷数为+2,配位数为4;[[Ag(NH3)2]Cl中中心离子是Ag+,电荷数为+1,配位数为2,故D错误;
故选B.
点评 本题考查了配合物的有关知识,明确配合物中內界、外界、配位体、配位数、中心离子的概念是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3molC | B. | 1molA,1molB,1molHe | ||
| C. | 2molA,1molC | D. | 2.5molA,0.5molB,1.5molC |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到限度时,正、逆反应速率相等 | |
| C. | 化学反应的限度与时间的长短无关 | |
| D. | 改变外界条件,化学反应的限度不可能改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
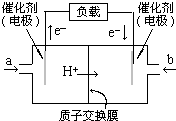 燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )
燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是空气 | |
| C. | 电池负极的反应式为:2C4H10+16H2O-52e-═8CO2+52H+ | |
| D. | 电池的正极反应式为:13O2+26H2O+52e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 颜色保持不变 | |
| B. | 气体密度保持不变 | |
| C. | 2v正(HI)=v逆(I2) | |
| D. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g/L) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合物 | 选择试剂 | 分离方法 |
| 二氧化硫(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com