
| A、后者仅存在水解平衡,不存在电离平衡 |
| B、两溶液中存在的粒子种类相同 |
| C、c(OH-)前者大于后者 |
| D、分别加入NaOH固体,恢复到原温度,c(CO32-)前者增大后者减小 |


科目:高中化学 来源: 题型:
| A、64g |
| B、32g?mol-1 |
| C、32g |
| D、64 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自发反应一定是放热反 |
| B、自发反应一定是吸热反应 |
| C、有的吸热反应也能自发进行 |
| D、吸热反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含碳原子的个数比为1:1 |
| B、所含氧原子个数1:2 |
| C、所含氧元素的质量比为14:11 |
| D、所占有的体积比为11:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64g?mol-1 |
| B、32g?mol-1 |
| C、32 |
| D、64 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ④CH≡CH⑤NH3 ⑥CH4.
④CH≡CH⑤NH3 ⑥CH4.| A、①②③ | B、①⑤⑥ |
| C、②③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:3 |
| C、2:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
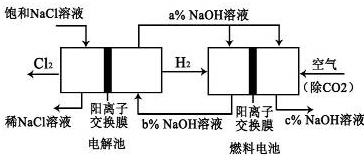
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com