
| A. | 2.24L | B. | 3.92L | C. | 3.36L | D. | 2.8L |
分析 将0.3mol KCl、0.2mol Cu(N03)2、0.1mol AgN03一起溶于水,配成100mL混合溶液,
发生的反应为AgNO3+KCl=AgCl↓+KNO3,根据方程式知,银离子完全沉淀,有0.1mol氯离子产生沉淀,所以溶液中溶质为0.2mol KCl、0.2mol Cu(N03)2、0.1molKN03,阳极上离子放电顺序是Cu2+、H+,阴极上离子放电顺序是Cl-、OH-,
用惰性电极电解一段时间后,若在一极析出9.6g Cu,析出n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol<0.2mol,所以铜离子没有完全放电,转移电子物质的量=0.15mol×2=0.3mol;
阴极上氯离子完全放电转移电子物质的量=n(Cl-)=0.2mol,还有0.1mol电子是氢氧根离子转移的,则生成氧气物质的量=$\frac{0.1mol}{4}$=0.025mol,根据V=nVm计算生成气体体积.
解答 解:将0.3mol KCl、0.2mol Cu(N03)2、0.1mol AgN03一起溶于水,配成100mL混合溶液,
发生的反应为AgNO3+KCl=AgCl↓+KNO3,根据方程式知,银离子完全沉淀,有0.1mol氯离子产生沉淀,所以溶液中溶质为0.2mol KCl、0.2mol Cu(N03)2、0.1molKN03,阳极上离子放电顺序是Cu2+、H+,阴极上离子放电顺序是Cl-、OH-,
用惰性电极电解一段时间后,若在一极析出9.6g Cu,析出n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol<0.2mol,所以铜离子没有完全放电,转移电子物质的量=0.15mol×2=0.3mol;
阴极上氯离子完全放电转移电子物质的量=n(Cl-)=0.2mol,还有0.1mol电子是氢氧根离子转移的,则生成氧气物质的量=$\frac{0.1mol}{4}$=0.025mol,
阳极生成气体物质的量=$\frac{1}{2}$n(Cl-)+n(O2)=$\frac{1}{2}$×0.2mol+0.025mol=0.125mol,
生成气体在标况下体积=0.125mol×22.4L/mol=2.8L,故选D.
点评 本题考查电解原理,为高频考点,正确判断阳极产物是解本题关键,熟练掌握离子放电顺序,注意结合转移电子守恒进行计算,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.
金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数之比为1:1 | B. | 原子数之比为1:1 | C. | 中子数之比为1:1 | D. | 密度之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
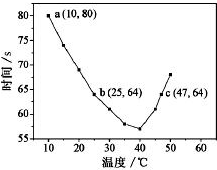 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 当NaHSO3完全消耗时的离子方程式为:6HSO3-+2IO3-=6SO42-+2I-+6H+ | |
| C. | 图中a点对应的NaHSO3反应速率为5.5×10-5mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
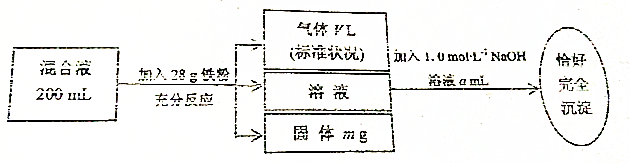
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com