
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
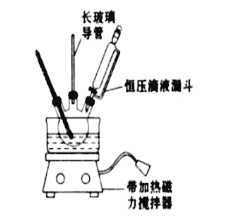
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:
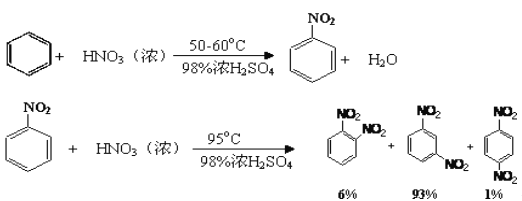
可能用到的有关数据列表如下:

请回答下列问题:
(1)配制混酸应先在烧杯中加入_______.
(2)恒压滴液漏斗的优点是_______,实验装置中长玻璃导管可用____________代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为___________________________
(4)反应结束后产品在液体的_____层(填"上"或"下"),分离混酸和产品的操作方法为____________
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?___________
(6)试剂A是________,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为_______________若加热后,发现未加沸石,应采取的正确方法______________________________________
(7)硝基苯的产率为_________.
【答案】浓硝酸 可以保持漏斗内压强与发生器内压强相等,使漏斗内液体顺利流下冷凝管 球形冷凝管或直形冷凝管均可 受热均匀,温度容易控制 上 分液 取最后一次洗涤液,加入氯化钙溶液,无沉淀生成,说明已洗净 氯化钙 防止暴沸 停止加热,冷却后补加 70%
【解析】
(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配置混酸应将浓硫酸加入到浓硝酸中,也就是先在烧杯中先加入浓硝酸,故答案为:浓硝酸。
(2)由于在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下;在实验的过程中苯、硝酸会因为加热而气化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此可用冷凝管等冷凝装置代替;故答案为:可以保持漏斗内压强与发生器内压强相等,使漏斗内液体顺利流下冷凝管;球形冷凝管或直形冷凝管均可。
(3)水浴加热可使反应受热均匀,温度容易控制,故答案为:受热均匀,温度容易控制。
(4)反应结束后产生的硝基苯、1,3-二硝基苯都不溶解于水的液体,密度比酸的混合溶液小,所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液,故答案为:上,分液。
(5)对于得到的粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有CO32-。所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净;故答案为:取最后一次洗涤液,加入氯化钙溶液,无沉淀生成,说明已洗净。
(6)为了得到更纯净的硝基苯,使之不含有水,可以先向液体中加入有吸水干燥作用的无水CaCl2,除去水,然后蒸馏就得到了产品;蒸馏实验中,沸石起到防止暴沸的作用,若实验开始后发现未加入沸石,需停止加热,冷却后补加,故答案为:停止加热,冷却后补加。
(7)因为苯的密度为0.88g/cm3,18mL苯的质量为18mL×0.88g/cm3=15.84g,根据反应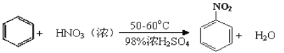 ,可以知道硝基苯的质量为
,可以知道硝基苯的质量为![]() g≈25g,故硝基苯的产率为
g≈25g,故硝基苯的产率为![]() ×100%=70%,故答案为:70%。
×100%=70%,故答案为:70%。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
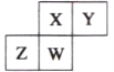
A. 原子半径:W>Z
B. 气态氢化物的稳定性:W>X
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1, 2-二溴乙烷,下列转化方案中最好的是
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH3
CH2BrCH3![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:

(1)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为___________________________________(不需注明反应条件)。
(2)下列物质不能与乙反应的是 (选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.乙酸
(3)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液显示紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用63%的浓HNO3 (其密度为1.40 g·mL-1)配制200 mL 0.50 mol·L-1稀HNO3。
(1)此浓硝酸的物质的量浓度为________mol·L-1。(计算结果保留两位小数)
(2)应量取63%的浓硝酸____________mL,应选用________( A.10 mL量筒或B.50 mL量筒,填仪器的字母编号)。
(3)实验时还需选用的玻璃仪器有玻璃棒、烧杯、_______________(填仪器的名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)________。
①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
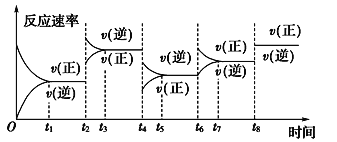
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末X,由BaCl2、K2SO4、CaCO3、NaOH、CuCl2、KCl中的一种或几种组成,为了探究其成分,进行了如下实验:
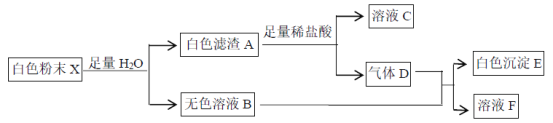
下列判断正确的是
A. 白色滤渣A可能为CaCO3、BaSO4的混合物
B. K2SO4、CuCl2一定不存在
C. KCl、K2SO4可能存在
D. CaCO3、BaCl2一定存在,NaOH可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com