
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、硫酸钠 | D. | 磷酸、生石灰、苛性钠 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铷比镁金属性强 | |
| B. | 氯化镁比氯化铷难溶 | |
| C. | 高温下,镁离子得电子能力比铷离子弱 | |
| D. | 铷的沸点比镁低,当把铷蒸气抽走时,平衡向右反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.4 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
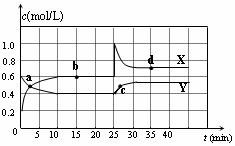
| A. | 图中的两条曲线,X表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)=0.02 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L | |
| D. | 该温度下反应的平衡常数 K=1.11 L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | H2S+Cl2=S+2HCl | D. | Cu2O+H2SO4=CuSO4+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 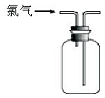 可用于氯气的收集 | B. | 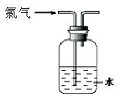 用于除去氯气中少量的氯化氢气体 | ||
| C. |  可证明氯气具有漂白性 | D. | 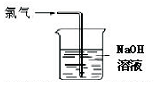 可用于实验室氯气的尾气吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3→NaCl | B. | SO3→H2SO4 | C. | MgO→Mg(OH)2 | D. | CaCO3→Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com