
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 计算:
计算:
(1)该条件下N2的平衡转化率______;(小数点后保留一位)
(2)该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数_______。(不带单位)
N2(g)+3H2(g)的平衡常数_______。(不带单位)
【答案】66.7% 5.0×10-3mol2·L-2
【解析】
设反应过程消耗x mol N2(g),
N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
起始物质的量/mol 0.60 1.60 0
平衡物质的量/mol 0.60-x 1.60-3x 2x
根据氨气的物质的量分数=氨气的量与平衡时各气体的总量的比值列方程求出x,再根据氮气的变化量与氮气的起始量之比,求出氮气的转化率;
(2)根据(1)可以知道各物质平衡时的物质的量,转化为浓度后,根据K=![]() ,带入数值进行计算。
,带入数值进行计算。
(1)设反应过程消耗x mol N2(g)。
N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
起始物质的量/mol 0.60 1.60 0
平衡物质的量/mol 0.60-x 1.60-3x 2x
平衡时反应体系总物质的量=(2.20-2x)mol;NH3(g)的物质的量分数=![]() =
=![]() ,解得x=0.40mol,则N2的平衡转化率=
,解得x=0.40mol,则N2的平衡转化率=![]() ×100%=66.7%;
×100%=66.7%;
(2)设反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数为K,平衡时,c(NH3)=
N2(g)+3H2(g)的平衡常数为K,平衡时,c(NH3)=![]() =0.40 mol·L-1,c(N2)=
=0.40 mol·L-1,c(N2)=![]() =0.10 mol·L-1,c(H2)=
=0.10 mol·L-1,c(H2)=![]() =0.20 mol·L-1,K=
=0.20 mol·L-1,K=![]() =
=![]() =5.0×10-3mol2·L-2。
=5.0×10-3mol2·L-2。
,


科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
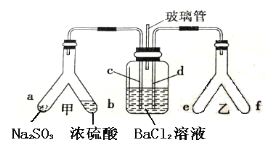
A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=______;若降低温度,K值将______(填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
(3)达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是_______ (填序号)。
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2

(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x____y(“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国斯坦福大学的工程师设计出一种从污水“提取”潜在电能的新型微生物电池,该电池能将生活污水中的有机物分解同时发电,电池结构如图所示。已知a电极为惰性材料,b电极为Ag2O。下列说法不正确的是( )

A.a电极是负极,b电极是正极
B.b电极发生的反应是Ag2O+2e-+2H+=2Ag+H2O
C.a电极每生成标准状况下2.24LCO2,可向b电极转移0.1mol电子
D.高温条件下,该电池不能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 1molCO和 2molH2充入一容积为 1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。根据图,下列分析中正确的是( )
CH3OH(g)。根据图,下列分析中正确的是( )
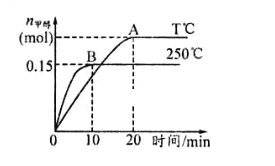
A.平衡时CO的转化率:250°C>T°C
B.该反应的正反应是放热反应
C.反应达平衡后,其他条件不变,若减小容积体积,CO 体积分数增大
D.250°C时,反应在前10s的平均速率υ(H2)=0.015mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为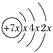 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的方程式正确的是
A.电解氯化镁溶液:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
B.碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–=CaCO3↓+H2O
+OH–=CaCO3↓+H2O
C.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液中加入稀硫酸:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com