
 请回答下列问题.
请回答下列问题.分析 (1)分子晶体熔沸点较低;
(2)①根据N2与CO为等电子体,结合等电子体结构相似判断;
②据CO2的结构式O=C=O判断;
(3)可根据硅晶体中Si-Si之间插入O原子形成SiO2分析;
硅原子周围有四个共价键与硅原子相连,其中任意两个共价键向外都可以连有两个最小的环.
解答 解:(1)分子晶体熔沸点较低,该物质的熔沸点较低,所以为分子晶体,故答案为:分子晶体;
(2)①N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;
②CO2的结构式为O=C=O,分子中C形成2个δ键,则1molCO2中含有的σ键数目为2×NA=2NA个,故答案为:2NA;
(3)金刚石晶体中,最小的环为六元环,也即由6个C原子构成,则晶体硅的六元环也是六个Si原子.当各Si-Si键上插入一个O原子,则共插入六个O原子,故最小的环上共有十二个原子即为十二元环;
晶体硅的结构和金刚石相似,硅原子周围有四个共价键与其相连,其中任意两个共价键向外都可以连有两个最小的环,如果把Si-O-Si键作为一个整体的话,可作如图所示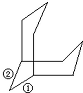 ,所以一个硅原子共用的最小环有C${\;}_{4}^{2}$×2=12种;
,所以一个硅原子共用的最小环有C${\;}_{4}^{2}$×2=12种;
故答案为:12;12.
点评 本题综合考查物质的结构与性质知识,侧重于晶体类型的判断、等电子体、杂化类型、晶体结构分析等知识,题目难度中等,注意把握杂化类型的判断方法.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N-H的键长比P-H的键长短,所以PH3的沸点比NH3低 | |
| B. | PH3分子的立体构型是三角锥形,与NH3互为等电子体 | |
| C. | PH3分子是极性分子,极易溶于水,因为它与水分子间存在氢键 | |
| D. | NH3比PH3稳定,因为NH3分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaOH溶液:K+、NH4+、I-、NO3- | |
| B. | 0.1 mol•L-1的CH3COOH溶液:CH3CH2OH、Na+、Al3+、SO42- | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Al3+、NO3-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-、NH4+、K+、SO42- | B. | CO32-、Cl-、Na+、K+ | ||
| C. | Mg2+、NO3-、C1-、Fe2+ | D. | K+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:| 阳离子 | NH4+ H+ Na+ |
| 阴离子 | OH-CH3COO- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O(g)含有的分子数约为NA | |
| B. | 常温常压下,5.85g NaCl含有的Na+离子数为0.1 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为0.5mol•/L的CH3COOH溶液中,含有CH3COOH个数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com