
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ/mol |
分析 A、根据物质的聚集状态来判断;
B、根据氢气燃烧生成水蒸气的逆过程为吸热过程来分析;
C、2mol氢气燃烧生成水蒸气放出484kJ热量,根据热化学方程式书写原则来判断;
D、根据反应放热时焓变符号为负来判断.
解答 解:A、生成的水应该为气态,而不是液态,故A错误;
B、2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,有:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1,故B正确;
C、反应为放热反应,此时焓变符号为负,2mol氢气燃烧生成水蒸气放出484kJ热量,2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol,故C正确;
D、反应为放热反应,此时焓变符号为负,故D错误.
故选BC.
点评 本题主要考查学生热化学方程式的书写原则,该题型是现在高考的热点,掌握书写方法和基础知识是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| B. | 二氧化硫具有还原性,能用于漂白纸浆 | |
| C. | 碳酸钠能和酸反应,常用于治疗胃酸过多 | |
| D. | 氧化铝熔点很高,用其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 mol | B. | 14 mol | C. | 16 mol | D. | 18 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
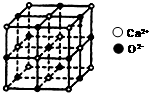 (1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.
(1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O | |
| B. | 用浓盐酸检验氨:NH3+HCl=NH4Cl | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,U型管的左端被水和胶塞封闭甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间.
如图所示,U型管的左端被水和胶塞封闭甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
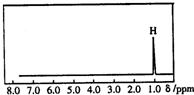 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )| A. | CH3C(CH3)3 | B. | CH3CH2CH3 | C. | CH2=CHCH3 | D. | (CH3)2CHCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com