
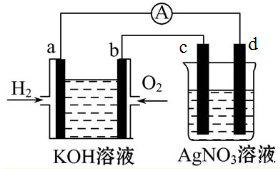
分析 氢氧燃料电池工作时,通入氢气的电极为负极即a极,发生氧化反应,在碱性溶液中,电极方程式为H2-2e-+2OH-=2H2O,通入氧气的电极为正极即b极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,总反应式为2H2+O2=2H2O,电解硝酸银溶液,与a极相连的d为阴极发生4Ag++4e-=4Ag,与b极相连的c为阳极发生4OH--4e-=2H2O+O2↑,总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,据此分析.
解答 解:氢氧燃料电池工作时,通入氢气的电极为负极即a极,发生氧化反应,在碱性溶液中,电极方程式为H2-2e-+2OH-=2H2O,通入氧气的电极为正极即b极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,总反应式为2H2+O2=2H2O,电解硝酸银溶液,与a极相连的d为阴极发生4Ag++4e-=4Ag,与b极相连的c为阳极发生4OH--4e-=2H2O+O2↑,总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,
(1)根据以上分析,电极a为负极,溶液中OH-移向a极,故答案为:负;a;
(2)电极b处所发生的电极反应方程式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)因为总反应式为2H2+O2=2H2O,则随着反应的进行,碱性减弱,所以氢氧燃料电池内部溶液的PH将减小,故答案为:减小;
(4)c极为阳极,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:阳;4OH--4e-=2H2O+O2↑;
(5)因为燃料电池总反应式为2H2+O2=2H2O,所以当氢氧燃料电池中消耗氢气1.12L(标准状况下)时,n(H2)=$\frac{1.12}{22.4}$=0.05mol,
由电极方程式H2-2e-+2OH-=2H2O可知转移电子0.1mol,电解硝酸银溶液,阴极d发生Ag++e-=Ag,所以d电极质量增加0.1×108=10.8g,故答案为:d;10.8.
点评 本题考查电化学知识,为高考常见题型,侧重于考查学生综合运用化学知识的能力和分析问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的原子核外电子数为53 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| D. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I为同种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 非金属单质中,一定有σ键,可能有π键 | |
| D. | 一个N2分子中有1个σ键,2个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应说明它是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出的热量多 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l),△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于 57.3 kJ | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液后生成的沉淀一定是AgCl | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.2mol/L c(CO32-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | z=4 | B. | B 的转化率是40% | ||
| C. | A 的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来压强的0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极 | B. | 阳极 | C. | 正极 | D. | 负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缺维生素A易患夜盲症 | B. | 缺铁易患白血病 | ||
| C. | 缺维生素C易患坏血病 | D. | 缺维生素D易患佝偻病 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com