
阿伏加德罗常数用NA表示,下列叙述正确的是()
①常温常压下,2.24LD2气体分子含有的中子数为小于0.2NA
②含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA
③0.44gC3H8中含有的极性共价键总数目为0.1NA
④7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA
⑤46g二氧化氮与四氧化二氮的混合气体的平均相对分子质量为46<M<92
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
A.①④⑤ B.⑤⑥ C.②④⑤⑥⑦ D.①③④⑤⑥
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是

A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I—的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上8月月考理综化学试卷(解析版) 题型:填空题
2015年9月爆发的德国大众车尾气排放作弊事件引起了公众的关注。大众车尾气中常含有大里氮氧化物.通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质。大众选择了一种违规做法,即在客户平时用车时不开启喷射尿素的尾气后处理系统,而是通过软件让这一系统只在尾气排放检测时启动。
I、通过NOx传感器可监测空气的NOx的含量,其工作原理图如下图,写出NiO电极的电极反应式__________________;
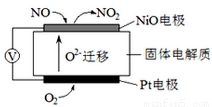
Ⅱ、以CO2与NH3为原料可合成尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ•mol-1
③H2O(l)=H2O(g) △H=+44.0kJ•mol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式____________;
(2)恒温下将2molNH3和1molCO2放入容积为2L的密闭容器中,反应生成NH2CO2NH4(s),2分钟后达到平衡。此时NH3的浓度为0.8mol/L,则CO2的反应速率为________,NH3的转化率是________。
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染。已知:
反应a:4NH3(g)+6NO(g) 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
反应b:2NO(g)+O2(g) 2NO2(g)
2NO2(g)
反应c: 4NH3(g)+6NO2(g) 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图所示。下列说法正确的是________________。
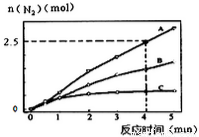
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)对于反应c来说,可加快反应速率的措施有_______________(任写2种)
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,在其他条件不变时,再充入NO2气体,NO2体积分数_______(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是()
A.60gSiO2含有的Si-O共价键数为2NA
B.常温常压下,1Llmol/L的亚硫酸钠溶液中的SO32-为NA
C.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.1.5molNO2与足量H2O反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:选择题
 晶体与
晶体与 的溶液反应后,生成氯气、氯化钾和水.下列说法正确的是()
的溶液反应后,生成氯气、氯化钾和水.下列说法正确的是()
A.氯化钾既不是氧化产物,也不是还原产物
B.被还原的 和被氧化的
和被氧化的 的物质的量之比为1:6
的物质的量之比为1:6
C.生成氯气的相对分子质量为72
D.每生成标准状况下的氯气11.2L,转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上学期开学考试化学试卷(解析版) 题型:填空题
W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y、Z为短周期元素,它们的单质在通常情况下均为无色气体。X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列问题:
(1)写出X的基态原子的价电子排布式_________________;
(2)比较X、Y两元素基态原子的第一电离能大小:X__________Y(填“>”、“<”或“=”),理由是________;
(3)W、X两元素能写出一种常见气体M,每个M分子中含有10个电子,M分子中心原子的杂化方式为_________;WX两种元素还能写出一种常见阳离子N,每个N中也含有10个电子,但在N与M中所含化学键的键角大小不同,其原因是__________;
(4)Z2+可与M分子在谁溶液中形成[Z(M)4]2+,其中M分子和Z2+通过__________-结合;
(5)单质Z的警报结构如图所示,已知两个最近的Z原子距离为a,Z的相对原子质量用Mr表示,则该晶体密度为_______________(只列计算式)。
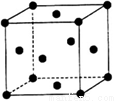
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上学期开学考试化学试卷(解析版) 题型:选择题
有机物 有多种同分异构体,其中属于酯类且氯原子直接连接在苯环上的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中属于酯类且氯原子直接连接在苯环上的同分异构体有多少种(不考虑立体异构)
A.19种 B.9种 C.15种 D.6种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上入学考试化学卷(解析版) 题型:实验题
科学探究是奇妙的过程,请你一起参与并填写下列空白。
【提出问题】小森同学在滴加FeCl3溶液时,不小心把滴加FeCl3溶液的滴管放入到盛“双
氧水”(过氧化氢)的试剂瓶中,发现有大量的气泡产生。小森联想到用二氧化锰可作为过氧化氢的催化剂,他想FeCl3溶液能否也可以作为过氧化氢分解的催化剂呢?于是他做了以下探究。
【猜想与假设】FeCl3溶液能作过氧化氢分解的催化剂
【设计与实验】
实验步骤 | 实验现象 | 实验结论 |
在一支试管中加入5mL15%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 | FeCl3溶液可以催化分解H2O2 |
【讨论与反思】
已知FeCl3溶液中含有H2O 、Fe3+和Cl-三种微粒,小森同学又做了三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的CI—
你认为最不可能的是那一种猜想, 。小森同学认为,要验证猜想,至少还需要做 个对比实验
查看答案和解析>>
科目:高中化学 来源:2017届湖北省枣阳市高三上学期8月调研化学试卷(解析版) 题型:选择题
对实验Ⅰ~Ⅳ的实验现象预测正确的是
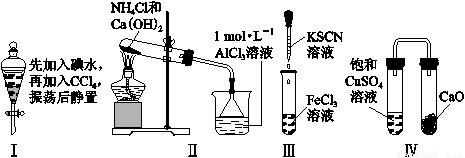
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中立刻出现红色沉淀
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com