
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成离子化合物,其阴阳离子个数比为1∶1。回答下列问题:
(1)五种元素中非金属性最强的是____(填元素符号)。
(2)由A和B、D、E所形成的共价化合物中,热稳定性最差的是___(用化学式表示)。
(3)C和E形成的离子化合物的电子式为 __,用电子式表示A和B形成的过程___,A和E形成的化合物与A和B形成的化合物反应,产物的化学式___
(4)D的最高价氧化物的水化物的化学式为____。
(5)由A和B形成的一种气体在工业上用途很广,实验室制取的方程式为____。
【答案】Cl PH3 ![]()
![]() NH4Cl H3PO4(HPO3) 2NH4Cl + Ca(OH)2
NH4Cl H3PO4(HPO3) 2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O
CaCl2 + 2NH3↑+2H2O
【解析】
五种短周期元素A、B、C、D、E的原子序数依次增大。A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素;A和C同族,C的原子序数大于氮元素,故C为Na元素;B和D 同族,则D为磷元素;C和E形成离子化合物,其阴阳离子个数比为1:1,则E为Cl元素。
(1)同周期自左而右非金属性增强,HCl中Cl元素表现负化合价,故Cl元素非金属性比氢元素的强,高氯酸的酸性强于硝酸的酸性,故Cl元素非金属性比N元素的强,则五种元素中非金属性最强的是Cl;
(2)由A和B、D、E所形成的共价型化合物分别为NH3、PH3、HCl。非金属性越强氢化物越稳定,非金属性Cl>N>P,故热稳定性最差的是 PH3;
(3)C和E形成的化合物为NaCl,电子式为![]() ;A和B形成NH3,用电子式表示过程:
;A和B形成NH3,用电子式表示过程:![]() ;A和E形成的化合物为HCl,A和B形成的化合物为NH3,二者反应生成NH4Cl;
;A和E形成的化合物为HCl,A和B形成的化合物为NH3,二者反应生成NH4Cl;
(4)D为磷元素,它的最高价氧化物的水化物的化学式为H3PO4;
(5)由A和B形成的一种气体在工业上用途很广,该气体为NH3,实验室制取NH3的方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】木炭跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示装置)。下列有关说法不正确的是( )

A.洗气瓶中产生的沉淀是碳酸钡B.在Z导管出来的气体中有二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是______(填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是__________,属于离子晶体的是_________,属于原子晶体的是_______,五种物质的熔点由高到低的顺序是__________。
(4)A、B、C、D为四种晶体,性质如下:
A 固态时能导电,能溶于盐酸
B 能溶于CS2,不溶于水
C 固态时不导电,液态时能导电,可溶于水
D 固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.______;B.______;C.________;D._____。
(5)相同压强下,部分元素氟化物的熔点见下表:
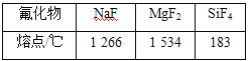
试解释上表中氟化物熔点差异的原因:__________
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________晶体,Ni(CO)4易溶于下列________(填序号)
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是人类进步的关键”。下列说法不正确的是 ( )
A.PM2.5是指空气中直径≤2.5 μm的固体颗粒或液滴的总称
B.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
D.![]() 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物![]() ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( )
①![]()
②![]()
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A.①③⑤B.②③④C.②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是___,氧化产物是___(填写化学式)。
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______(填编号)。
A.NaClB.NH4ClC.HNO3D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com