
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
分析 A.根据非金属性的强弱判断,一般来说,非金属性越强,对应的单质的氧化性越强;
B.同种非金属元素之间形成非极性键;
C.S2Cl2是黄红色油状发烟液体,可说明沸点较低,硫磺也是分子晶体;
D.遇水分解出无色有刺激性气味的气体,且溶液变浑浊,说明生成二氧化硫和硫.
解答 解:A.非金属性Cl>S,氯气的氧化性较强,故A错误;
B.S2Cl2的结构式为Cl-S-S-Cl,分子中存在S-S非极性键,故B错误;
C.S2Cl2是黄红色油状发烟液体,可说明沸点较低,应为分子晶体,硫磺也是分子晶体,故C错误;
D.反应为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,S元素的化合价既升高又降低,既体现氧化性又体现还原性,故D正确.
故选D.
点评 本题考查氧化还原反应,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意判断发生的氧化还原反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
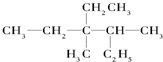 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷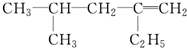
 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: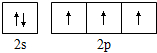 | ||
| C. | CO2的比例模型: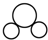 | D. | Cl-的结构示意图: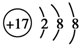 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是极性键形成的极性分子 | |
| B. | 它们的成键方式都只有σ键 | |
| C. | 可燃冰的存在说明甲烷和水分子间能形成氢键 | |
| D. | 它们的分子空间构型都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
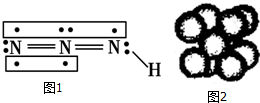 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.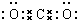 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
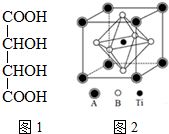 钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.
钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
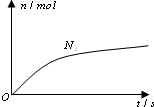 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com