
| A.C1-、Br-、I- | B.Br-、C1-、I- |
| C.I-、Br-、C1- | D.Br-、I-、C1- |
科目:高中化学 来源:不详 题型:单选题
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH
| ||
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | ||
C.室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中
| ||
| D.在0.1mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3水溶液呈碱性,所以其热溶液可以除去物品表面的油污 |
| B.Fe(OH)3胶体能吸附水中的悬浮颗粒并沉降,因而具有净水作用 |
| C.氯化亚铁溶液与无色的KSCN溶液混合,溶液不呈红色 |
| D.SO2通入品红溶液,红色褪去,再加热,红色不再出现 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | ① | ② | ③ | 实验结论 | 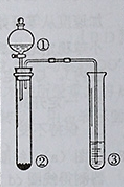 |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沉淀中只有Fe(OH)3 | B.沉淀中有Fe(OH)3和Fe(OH)2 |
| C.滤液c(Fe3+)=4.0×10-8mol/L | D.向滤液中滴加FeCl2溶液,无沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com