
分析 写出分子式C5H12的各种同分异构体,再根据等效H判断各种同分异构体一氯代物的种数,二氯烷烃采取定一移二法分析.
解答 解:分子式C5H12的同分异构体,有以下三种(C骨架结构):
1、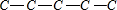 ,正戊烷有3种H原子,有3种一氯代物;
,正戊烷有3种H原子,有3种一氯代物;
2、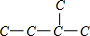 ,异戊烷有4种H原子,有4种一氯代物;
,异戊烷有4种H原子,有4种一氯代物;
3、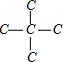 ,异戊烷有1种H原子,有1种一氯代物;
,异戊烷有1种H原子,有1种一氯代物;
4、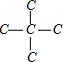 ,有1种H原子,两个氯原子可取代同一甲基上的两个氢原子,也可以分别取代两个甲基上的氢原子,因此有2种二氯烷烃,
,有1种H原子,两个氯原子可取代同一甲基上的两个氢原子,也可以分别取代两个甲基上的氢原子,因此有2种二氯烷烃,
答:(1)如果一元氯代烷有三种,是正戊烷;
(2)如果一元氯代烷只有一种,新戊烷;
(3)如果一元氯代烷有四种,是异戊烷;
(4)如果二元氯代烷有两种,是新戊烷.
点评 本题考查了同分异构体的书写,为高考高频点,同分异构体有碳链异构、官能团异构、顺反异构,根据等效氢种类判断即可,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 小苏打 | 干冰 |
| B | 蒸馏水 | 氨水 | 火碱 | 二氧化硫 |
| C | 硫酸 | 胆矾 | 纯碱 | 氨气 |
| D | 硝酸 | 食盐 | 氢氧化钠溶液 | 生石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液通入SO2:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 少量的Na2SO3溶液滴加到足量稀盐酸中:SO32-+2H+═H2O+SO2↑ | |
| D. | 硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H20═H2SiO3(胶体)+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
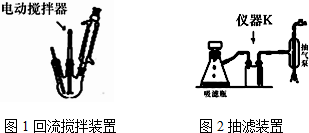
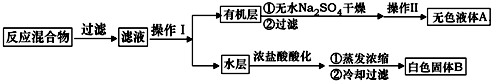
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
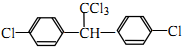 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共平面 | ||
| C. | 分子式为C14H9Cl5 | D. | 能发生水解反应和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
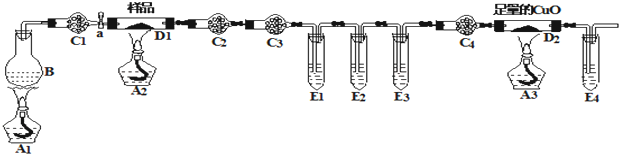
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com