
【题目】人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉. Ⅰ.废液组成:
金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
浓度(gL﹣1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
Ⅱ.处理方案:
(1)步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2. 此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是 .
(2)步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤. ①Mn2+反应生成MnO2同时放出CO2 , 写出此反应的离子方程式: .
②Co2+反应生成Co(OH)3沉淀同时放出CO2 , 写出此反应的离子方程式:;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式: .
③此步骤中必须控制好NaClO溶液的用量,其原因可能是 .
(3)步骤3:回收镍 以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是: .
②电解的最佳pH范围是:(填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.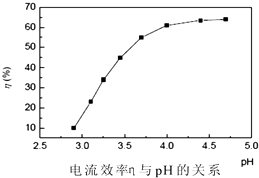
【答案】
(1)产生大量的CO2不利于工业生产
(2)Mn2++ClO﹣+CO32﹣=MnO2↓+Cl﹣+CO2↑;2Co2++ClO﹣+2CO32﹣+3H2O=2Co(OH)3↓+Cl﹣+2CO2↑;Co2++Ni(OH)3=Co(OH)3↓+Ni2+;Mn2+ , Co2+沉淀完全而Ni2+不被沉淀
(3)产生大量氢气;C
【解析】解:步骤1:饱和Na2CO3溶液能与酸反应生成二氧化碳气体,产生大量的CO2不利于工业生产,所以答案是:产生大量的CO2不利于工业生产; 步骤2:①Mn2+被ClO﹣氧化成+4价的Mn,以MnO2的形式被除去,ClO﹣被还原成Cl﹣ , 同时放出CO2 , 离子方程式为:Mn2++ClO﹣+CO32﹣=MnO2↓+Cl﹣+CO2↑,
所以答案是:Mn2++ClO﹣+CO32﹣=MnO2↓+Cl﹣+CO2↑;②Co2+被ClO﹣氧化成+3价的Co,以Co(OH)3的形式被除去,ClO﹣被还原成Cl﹣ , 同时放出CO2 , 离子方程式为:2Co2++ClO﹣+2CO32﹣+3H2O=2 Co(OH)3↓+Cl﹣+2CO2↑,Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,离子方程式为:Co2++Ni(OH)3=Co(OH)3↓+Ni2+ , 所以答案是:2Co2++ClO﹣+2CO32﹣+3H2O=2 Co(OH)3↓+Cl﹣+2CO2↑;Co2++Ni(OH)3=Co(OH)3↓+Ni2+;③Ni(Ⅲ)和Co(Ⅲ)都有很强的氧化性,但Ni(Ⅲ)非常不稳定,氧化性比Co(Ⅲ)化合物的氧化性强,因此只要ClO﹣适量,即使Ni2+被氧化生成了三价镍的化合物,也会被未参加反应的Co2+、Mn2+还原为Ni2+ , 因此防止Ni2+被沉淀的方法就是控制ClO﹣的用量,所以答案是:Mn2+ , Co2+沉淀完全而Ni2+不被沉淀;步骤3:从图中曲线变化趋势可以看出,当溶液酸性较大时,电解效率很低,随着pH的增大,电解效率增大,但是当pH>4.5后,电解率与溶液pH变化不明显.因此此处要重点分析pH较小时电解效率不高,以及pH较大时电解效率也不高的原因.由于H+、Ni2+都能在电极的阴极放电,所以当pH较小,也即[H+]较大时,将产生大量的氢气,造成电解效率较低.当pH较大时,由于Ni2+生成了难溶物,溶液中[Ni2+]减小,也造成电解效率低.因此,从图中可以看出来,最佳的pH范围大约为4.0~4.5.
所以答案是:①产生大量氢气;②C.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】完成下题
(1)已知:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1;
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2 , 则△H1△H2
(2)在298K、100kPa时,已知:
2H2(g)+O2(g)═2H2O(g)△H1
2HCl(g)═Cl2(g)+H2(g)△H2
4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H3
则△H3与△H1和△H2的关系是:△H3=
(3)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染.已知一定条件下:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJmol﹣1
则该条件下,用CH4还原NO2至N2的热化学方程式为:
(4)乙烯是石油裂解气的主要成分之一,25℃、101kPa时,1g乙烯燃烧生成CO2气体与液态水,放出50.5kJ的热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行的相应实验,不能达到实验目的是( ) 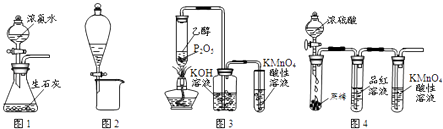
A.用图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制取乙烯并验证其易被氧化
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写热化学方程式(是离子反应的也可用离子方程式表示).
(1)表示强酸和强碱中和热的热化学方程式: .
(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环.测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式: .
(3)由氢气和氧气反应生成1mol水蒸气.放热241.8kJ.写出该反应的热化学方程式: . 若1g水蒸气转化成液态水放热2.5kJ,则反应H2(g)+ ![]() O2(g)═H2O的△H=kJmol﹣1 , H2的燃烧热为 .
O2(g)═H2O的△H=kJmol﹣1 , H2的燃烧热为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,用2a molL﹣1NaOH溶液滴定1.0L2a molL﹣1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是 ( )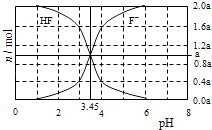
A.pH=3时,溶液中:c(Na+)<c(F一)
B.c(F一)>c(HF)时,溶液一定呈碱性
C.pH=4时,溶液中:c(HF)+c(Na+)+c(H+)﹣c(OH﹣)<2amolL﹣1
D.pH=3.45时,NaOH溶液恰好与HF完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:①2H2+4OH﹣-4e﹣=4H2O,②O2+2H2O+4e﹣=4OH﹣ 当得到1.8L饮用水时,电池内转移的电子数约为( )
A.1.8mol
B.3.6mol
C.100mol
D.200mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.古代的鎏金工艺利用了电解原理
B.“丹砂(HgS)烧之成水银,积变又还成丹砂”互为可逆反应
C.古代所用“鼻冲水”为氨水,其中含有5种微粒
D.“凡酸坏之酒,皆可蒸烧”中涉及蒸馏操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事故的处理方法正确的是
A. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
B. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦。
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗。
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛稀盐酸的盆中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于取代反应的是
A. 乙酸乙酯的水解反应
B. 甲烷在光照条件下与氯气发生反应
C. 苯与浓硫酸和浓硝酸的混合液共热
D. 在铜作催化剂的条件下,乙醇与氧气反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com