
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:____。
(2)某小组设计了如图所示的实验装置用于制备ClO2。
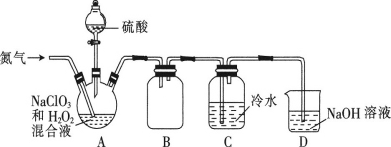
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____。
②装置B的作用是____。
③装置A用于生成ClO2气体,该反应的离子方程式为____。
④当看到装置C中导管液面上升时应进行的操作是___。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O,I2+2S2O32-=2I-+S4O62-),测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为___mol·L-1。
【答案】2ClO2+2CN-=2CO2+N2+2Cl- 稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 防止倒吸(或作安全瓶) 2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O 加大氮气的通入量 淀粉溶液 0.04
【解析】
(1)ClO2可将废水中的CN氧化成CO2和N2,离子方程式为:2ClO2+2CN=2CO2+N2+2Cl;故答案为:2ClO2+2CN=2CO2+N2+2Cl;
(2)①由于二氧化氯(ClO2)在混合气体中的体积分数大于10%就可能发生爆炸,氮气可以起到搅拌作用,还能稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;故答案为:稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②ClO2气体易溶于水,故B的作用是防止倒吸(或作安全瓶);故答案为:防止倒吸(或作安全瓶);
③装置A为NaClO3和H2O2在酸性条件下生成ClO2气体,化学反应为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,所以离子方程式为2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O;故答案为:2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O;
④装置C中导管液面上升说明ClO2浓度过大,为防止发生爆炸,应加大氮气的通入量;故答案为:加大氮气的通入量;
(3)ClO2溶液加入足量的KI溶液和H2SO4酸化氧化I为I2,用淀粉做指示剂,溶液蓝色褪去且半分钟内不恢复原色达到滴定终点;根据关系式:2ClO25I210Na2S2O3,则n(ClO2)=![]() =
=![]() ,C中ClO2溶液的浓度为
,C中ClO2溶液的浓度为![]() ;故答案为:淀粉溶液;0.04。
;故答案为:淀粉溶液;0.04。


科目:高中化学 来源: 题型:
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
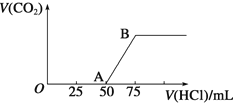
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是 ( )

A.a1=![]() B.a2=1C.b1=
B.a2=1C.b1= ![]() D.b2=
D.b2=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所涉及的物质均为中学化学中的常见物质,其中C、D均为气体单质,E是固体单质,A物质的焰色反应火焰为紫色,F是黑色晶体,它们存在如图转化关系,反应中生成的水及次要产物均的已略去。
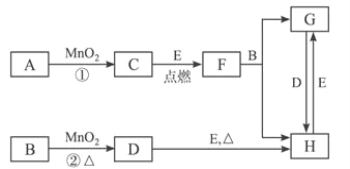
(1)写出下列物质的化学式:C_____________,D______________,H____________。
(2)指出MnO2在相关反应中的作用:反应①中做_______剂,反应②中做_________剂。
(3)当①中有1molA完全反应时转移电子的物质的量是________mol。
(4)检验G中阳离子的方法_________________________________________ 。
(5)保存G溶液时为什么要加固体E_____________________________________。
(6)写出F→G+H的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A. FeCl3溶液滴入Mg(OH)2浊液,白色浊液转化为红褐色沉淀
B. AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄色褪去
C. Na放在坩埚里并加热,发生黄色火焰,生成淡黄色固体
D. H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.蛋白质溶液属于胶体,能透过滤纸.
B.在水溶液中或熔融状态下能导电的物质是电解质
C.能电离出氢离子的化合物是酸
D.胶体带电荷,所以会产生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下图中仪器的名称:a.____,b.____。
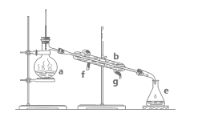
(2)若利用上图装置分离四氯化碳和酒精的混合物,还缺少的仪器是_______,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(3)现需配制0.1mol/L NaOH溶液450mL,下图是某同学转移溶液的示意图。
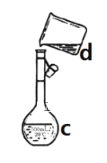
①图中的错误是__________。
②根据计算得知,需称量NaOH的质量为_____。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④若实验遇下列情况,溶液的浓度是偏大、偏小还是无影响.
A.溶解后没有冷却便进行定容__________________;
B.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀___________________;
C.定容时俯视容量瓶的标线___________________;
D.容量瓶内壁附有水珠而未干燥处理___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
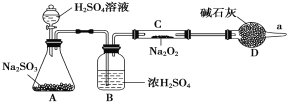
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com