
| A. | 1与8 | B. | 9与11 | C. | 6与16 | D. | 12与17 |
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 15mL | B. | 小于15mL | C. | 大于15mL | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
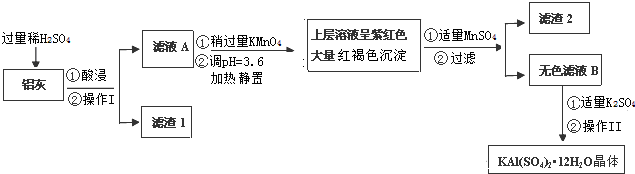
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 7.5 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
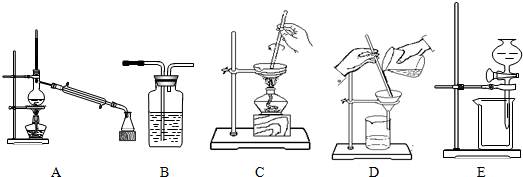
| 实验 | 所需分离操作 |
| 1.某活动小组用海水制取粗盐 | |
| 2.某活动小组从原油中分离出汽油、煤油等 | |
| 3.某活动小组将粗盐溶于水,除去其不溶的泥沙 | |
| 4.某活动小组用氢氧化钠溶液洗去CCl4中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
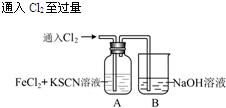 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
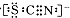
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com